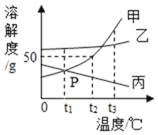
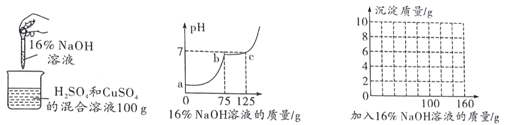
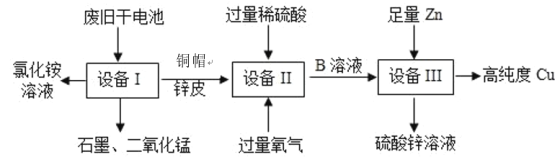
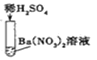【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是 否发生复分解反应。
(查阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于酸。
(实验与探究)
操作 | 现象 | 实验解析 | 结论 | |
实验一 |
| ①________ | 化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中 有气体或 有④____ 或有沉淀 生成时, 复分解反 应可以发 生。 |
实验二 | 适量的稀硫酸
| 溶液颜色 由红色恰 好变为无 色 |
| |
实验三 |
| 产生白色 沉淀 | 该反应的实质是:Ba2++SO42-=BaSO4↓ |
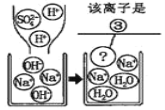
实验三结束后,某同学出于好奇,把实验三试管里的上层清液 a 倒入另一支洁净的试管中,向清液 a 中逐滴滴加 K2CO3 溶液。在滴加过程中,发现先产 生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液 a 中的溶质是⑤______。
(拓展)将稀盐酸、Ca(OH)2 溶液、NaCl 溶液、Na2CO3 溶液任意两种溶液相 混合,写出能发生反应且有沉淀生成的化学方程式______。
(反思)复分解反应的实质是朝着单位体积内______(填微粒种类 名称)数目减小的方向进行。