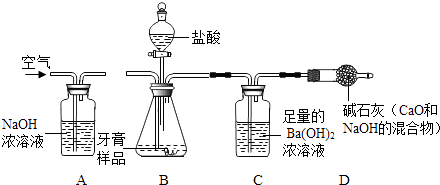
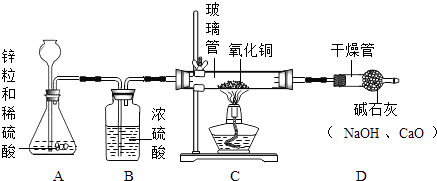
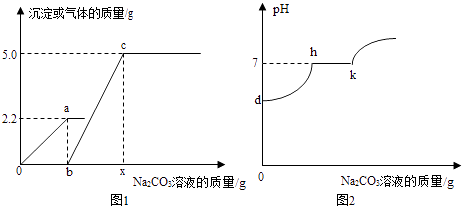
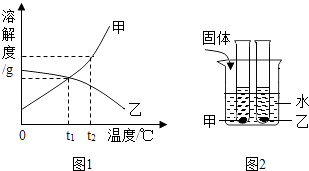
0 193797 193805 193811 193815 193821 193823 193827 193833 193835 193841 193847 193851 193853 193857 193863 193865 193871 193875 193877 193881 193883 193887 193889 193891 193892 193893 193895 193896 193897 193899 193901 193905 193907 193911 193913 193917 193923 193925 193931 193935 193937 193941 193947 193953 193955 193961 193965 193967 193973 193977 193983 193991 211419