题目内容
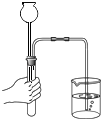
【题目】牙膏中常用碳酸钙、二氧化硅等物质作为摩擦剂.某同学对牙膏中摩擦剂碳酸钙的含量进行探究. 【实验原理】测定C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数.
【查阅资料】CO2+Ba(OH)2=BaCO3↓+H2O,牙膏中其他成分遇到盐酸时无气体产生.
【实验装置】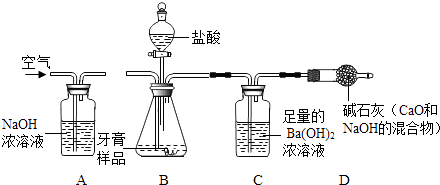
根据探究过程回答下列问题:
(1)装置B中发生反应的化学方程式;
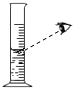
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②;
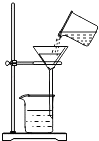
(3)从C中过滤出BaCO3沉淀所需的玻璃仪器有烧杯、和玻璃棒;
(4)实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g.则样品中CaCO3的质量分数为;
(5)若没有A装置,直接通入空气,则测得CaCO3的质量分数(填“偏大”、“偏小”或“不变”).
【答案】
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)使生成的二氧化碳完全被氢氧化钡溶液吸收
(3)漏斗
(4)25%
(5)偏大
【解析】解:(1)装置B中,盐酸能和碳酸钙反应,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑. 故填:CaCO3+2HCl═CaCl2+H2O+CO2↑.(2)持续缓缓通入空气,可以使反应生成的二氧化碳完全被氢氧化钡溶液吸收.
故填:使生成的二氧化碳完全被氢氧化钡溶液吸收.(3)过滤所需的玻璃仪器有烧杯、漏斗和玻璃棒.
故填:漏斗.(4)由CaCO3+2HCl═CaCl2+H2O+CO2↑、CO2+Ba(OH)2=BaCO3↓+H2O可知,CaCO3~BaCO3 ,
设碳酸钙的质量为X,
CaCO3~ | BaCO3 , |
100 | 197 |
x | 1.97g |
![]() =
= ![]()
X=1.00g,
碳酸钙的质量分数为: ![]() ×100%=25%.
×100%=25%.
故填:25%.(5)若没有A装置,直接通入空气,则空气中的二氧化碳进入C装置中,被氢氧化钡吸收,从而导致生成的沉淀偏多,计算出的碳酸钙偏多,最后求出的碳酸钙的质量分数偏大.
故填:偏大.
碳酸钙能和盐酸反应生成氯化钙、水和二氧化碳;
控制好相关量是做好实验的基础;
过滤可以把不溶于水的物质除去;
根据化学方程式可以求出碳酸钙的质量分数.