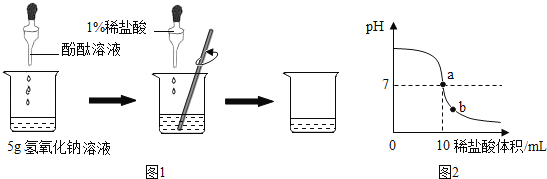
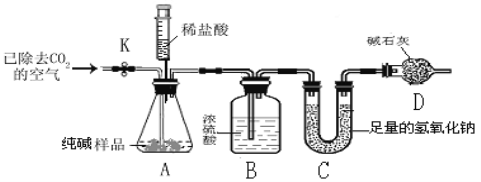
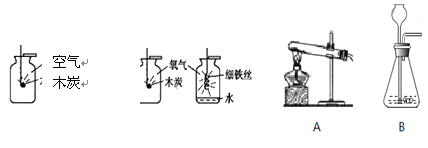
0 189956 189964 189970 189974 189980 189982 189986 189992 189994 190000 190006 190010 190012 190016 190022 190024 190030 190034 190036 190040 190042 190046 190048 190050 190051 190052 190054 190055 190056 190058 190060 190064 190066 190070 190072 190076 190082 190084 190090 190094 190096 190100 190106 190112 190114 190120 190124 190126 190132 190136 190142 190150 211419