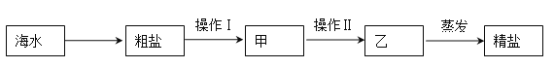
��Ŀ����
����Ŀ��ͬѧ����ʵ������5%��H2O2��Һ��ȡ������������������ʵ�顣
��Һ���ƣ�
��1�� ��50ml 30%��H2O2��Һ����5%��H2O2��Һ����Һ���ƹ����У����õ��������
���õ����������е�_____________��
a��������ƽ b���ձ� c��©�� d����Ͳ e����ͷ�ι�
�����Ʊ���
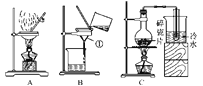
��2�� �����ƺõ�5%H2O2��Һ��MnO2��ȡO2���㽫ѡ��______________ ���� A��B��װ����Ϊ�÷�Ӧ�ķ���װ�ã�ѡ��÷���װ�õ�������_______________________________________���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________________������Ӧ������ͬѧ�ǻ����˻�����е�MnO2��ʵ�����Ϊ_______ ���
����ʵ�飺
��3�� С�����ռ��õ������������������ʵ��:
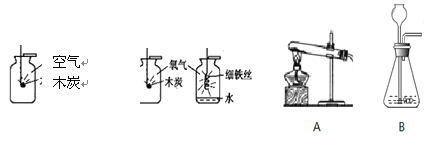
�ٷֱ�ѵ�ȼ��ľ̿����װ�п����������ļ���ƿ��ȼ�գ��Ա�ľ̿�ڿ�����������ȼ�յ�����˵��Ӱ��ȼ�վ��ҳ̶ȵ�һ��������_________________________��
���ѹ�����ϸ��˿�̳�����״��ȼ�������뼯��ƿ�У��۲쵽��������__________________________ ��
���𰸡�
��1�� bde
��2�� B�� ��Ӧ���ǹ����Һ������Ӧ����Ҫ���� �� 2H2O2![]() 2H2O+O2�� �� ����
2H2O+O2�� �� ����
��3�� ������Ũ�ȣ���˿����ȼ�գ�������������һ�ֺ�ɫ������
��������
�����������1����Һ���ƣ���50g30%��H2O2��Һ����5%��H2O2��Һ������Ϊ�����㡢��ȡ���ܽ⣬�����Ҫ�������У���Ͳ����ͷ�ιܡ��ձ������������ʳ��õ��������⣬�����õ����������е�bde��
��2�������Ʊ���B����Ӧ���ǹ����Һ������Ӧ����Ҫ���� ���ù���������Һ�ڶ������������������²���������ˮ����Ӧ�ķ���ʽΪ�� 2H2O2![]() 2H2O+O2������Ϊ��������������ˮ���ʲ��ù��ˡ�ϴ�ӡ�������л��ա�
2H2O+O2������Ϊ��������������ˮ���ʲ��ù��ˡ�ϴ�ӡ�������л��ա�
��3�� ������Ũ�ȵĸߵͷ�Ӧȼ�վ��ҳ̶ȣ�Ũ��Խ��ȼ��Խ������˿����ȼ�գ�������������һ�ֺ�ɫ������

 �������ϵ�д�
�������ϵ�д�