某化学兴趣小组用浓盐酸配制的稀盐酸来跟石灰石反应制取CO2.在用澄清石灰水检验制得CO2时,一直没有出现白色浑浊现象。对此异常现象,该小组进行下面的探究过程,请你参与他们探究活动并填答有关问题:
(提出问题)制得的CO2不能使石灰水变浑浊的原因是什么?
(猜想假设)猜想一:澄清石灰水_____(填“完全”或“部分”)变质;
猜想二:配制的稀盐酸浓度过大,CO2中含有挥发出来的HCl气体。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
①取少量该实验所用澄清石灰水于试管中,滴加_____ | 溶液变红色 | 猜想一不成立 |
②将所得气体通入稀HNO3和AgNO3的混合溶液中振荡。 | _____ | 猜想二成立,化学方程式:_____ |
(实验结论)配制盐酸浓度较大,应继续稀释。
(反思拓展)①纯净CO2不断通入澄清石灰水,石灰水先变浑浊后变澄清,是因为过量的CO2跟生成的CaCO3反应生成可溶的Ca(HCO3)2,涉及反应为CO2+H2O+CaCO3═Ca(HCO3)2,已知CO2通入Na2CO3溶液可发生类似的反应,则反应方程式为:_____。
②结合①提供的信息,若除去CO2中混有的少量HCl气体,可选择的最佳试剂是_____(填字母序号)。
A NaOH溶液 B Na2CO3溶液
C 饱和NaHCO3溶液 D AgNO3溶液
用某矿石(主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质)制取MgO的工艺流程简图如图:
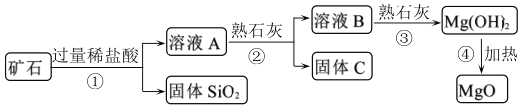
回答下列问题:
(1)步骤①和步骤②均用到的操作是_____。
(2)溶液A一定_____ (填“有”或“没有”)颜色,其中所含质量最小的阳离子是_____(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的pH范围为_____,固体C中所含成分的化学式为_____。
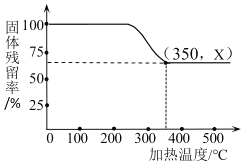
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图所示。则在上述流程步骤④中,加热的温度至少_____℃以 上,图中拐点的X值为_____(取整数)。
(5)写出步骤①中Fe2O3溶于盐酸的反应化学方程式:_____。
(6)上面工业流程中不用石灰水代替熟石灰工业意义是:_____(答一条即可)。
 。
。