题目内容
【题目】“鱼浮灵”主要成分是过碳酸钠(xNa2CO3yH2O2),俗称固体双氧水。兴趣小组对其进行以下探究:
[性质探究]
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加少量MnO2粉末,产生大量气泡。将带火星木条伸入试管内,木条_________,说明有O2生成。
(2)取实验(1)中上层清液,测得溶液PH>7;向溶液中滴加足量稀硫酸,产生大量气泡,将产生的气体通入澄清石灰水中,出现浑浊现象,说明有___________生成。写出实验中两个反应的化学方程式_______________、______________。
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
[工业制备]

[查阅资料]异丙醇是一种有机溶剂,过碳酸钠在异丙醇中溶解度较小。
(3)稳定剂的作用是___________________。
(4)操作Ⅱ中洗涤晶体的试剂最好选用_______________(填字母)。
A.饱和NaCl溶液 B.水 C.异丙醇 D.稀盐酸
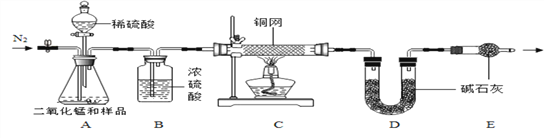
[组成探究]
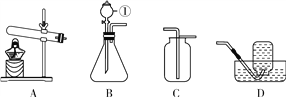
(5)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是___________________。
(6)装置B的作用是_______(填序号)①除去气体中的水蒸气②便于观察和控制气流速度装置C中的现象是____________,装置E的作用是___________。
(7)实验测得C装置中铜网增重1.2g,D装置增重2.2g。x:y=________。(写计算过程)
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值__________(填“偏大”或“偏小”)。
【答案】 复燃 二氧化碳 Na2CO3+H2SO4==Na2SO4+H2O+CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O 防止过氧化氢分解 C 使生成的氧气和二氧化碳完全被后续装置吸收。 ①② 红色铜网变黑 防止空气中的二氧化碳和水蒸气进入D装置 碳酸钠5.3g 、过氧化氢2.55g、x:y=2:3 偏大
【解析】本题主要考查氧气、二氧化碳的检验和测量,化学方程式的书写和计算,运用所学化学知识综合分析和解决实际问题的能力。
(1)氧气能使带火星的木条复燃;
(2)二氧化碳能使澄清石灰水变浑浊;实验中两个反应是碳酸钠与硫酸反应生成硫酸钠和水和二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式分别为:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑、CO2+Ca(OH)2==CaCO3↓+H2O;
(3)实验中加入稳定剂的作用是为防止H2O2分解而失效;
(4)因过碳酸钠不溶于异丙醇,所以洗涤晶体最好选用异丙醇,故选C;
(5)实验前通氮气一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应是为了除去装置内的氧气;实验后还要继续通氮气是为了使生成的氧气和二氧化碳完全被后续装置吸收;
(6)装置B的作用是干燥气体,防止水分进入D装置使测定值偏大;同时便于观察和控制气流速度以使反应充分进行,所以答案为①②;铜和氧气反应生了黑色的氧化铜,装置C中的现象是红色铜网变黑,装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置。
(7)C装置中铜网增重1.2g,则说明生成氧气的质量为1.2g,因为生成氧气的质量为1.2g,则设需要过氧化氢的质量为x
2H2O2~O2↑
68 32
x 1.2g
则![]() ,解得x=2.55g,
,解得x=2.55g,
因为D装置增重2.2g说明生成二氧化碳2.2g,则设需要碳酸钠质量为y
Na2CO3~CO2
106 44
y 2.2g
则![]() ,解得y=5.3g,故计算反应的碳酸钠质量为5.3g,
,解得y=5.3g,故计算反应的碳酸钠质量为5.3g,
根据“产品中活性氧含量测定和过碳酸钠(xNa2CO3yH2O2)组成”,则可得:106x:34y=5.3g:2.55g,故解得x:y=2:3。
(8)若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大。

 习题精选系列答案
习题精选系列答案