题目内容
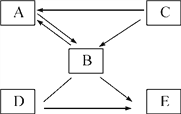
【题目】有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
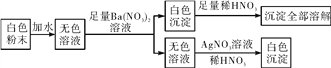
(1)根据实验现象,白色粉末中一定有__________。
(2)实验中不能用BaCl2溶液代替Ba(NO3)2溶液的理由是___________。
【答案】 氯化钠、碳酸钠 会干扰氯化钠的检验
【解析】根据所学知识和题中信息知,白色粉末遇水呈无色溶液,一定没有硫酸铜,硫酸铜水溶液呈蓝色。无色溶液加热硝酸钡有白色沉淀,可能有碳酸钠、硫酸钠中的一种或两种。白色沉淀加硝酸全部溶解,一定没有硫酸钠,硫酸钡不溶于硝酸;一定有碳酸钠。无色溶液进入硝酸银和硝酸产生白色沉淀,一定有氯化钠,氯化钠与硝酸银反应生成不溶于硝酸的白色沉淀。(1)根据实验现象,白色粉末中一定有氯化钠、碳酸钠。(2)实验中不能用BaCl2溶液代替Ba(NO3)2溶液的理由是会干扰氯化钠的检验。
点睛∶这是一道鉴别题,掌握常见物质的性质并灵活应用复分解反应的条件是顺利完成本实验的重要保证。硫酸铜水溶液呈蓝色。硫酸钡不溶于硝酸,氯化银不溶于硝酸。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
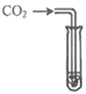
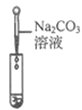
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。