��Ŀ����
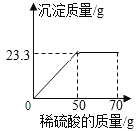
����Ŀ��ij���������п��ܺ���NaCl��BaCl2��NaOH�е�һ�ֻ��֡�ijУ����С��ͬѧΪ��̽����ɷ֣�ȡ�ù�������30g��ȫ����ˮ�У������Һ��pHΪ7��Ȼ��70gijϡ����������Һ�У���ַ�Ӧ�����������������������Ĺ�ϵ��ͼ��ʾ�������ͼʾ�����֪ʶ�ش����⡣
��1���ù���������һ�������е�������_____����ѧʽ����
��2��ͨ������ȷ���������ʵ���ɳɷּ�����_____��
��3������ϡ���������ʵ����������Ƕ��٣�_____
���𰸡���1��NaOH����2��BaCl220.8g��NaCl9.2g����3��19.6%
��������
��1�����ڼ���ˮ�ܽ���ҺpHΪ7��Ϊ���ԣ����Թ��岻��NaOH�����NaOH��
��2������ͼʾ��֪����Ӧ������50g���������ɳ�������Ϊ23.3g���������Ȼ�����Ӧ�������ᱵ���������ᡣ������23.3g���ᱵ������BaCl2������Ϊx��H2SO4������Ϊy��
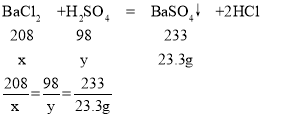
x��20.8g
y��9.8g
ԭ������NaCl������Ϊ��30g��20.8g��9.2g
���Ըù����к���BaCl220.8g��NaCl9.2g��
��3����ϡ���������ʵ���������Ϊ��![]() ��100%��19.6%
��100%��19.6%
��ϡ���������ʵ�����������19.6%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ѧϰ�ˡ�����кͷ�Ӧ����ͬѧ�ǿ�չ��ʵ��̽����
��ʵ��һ��С��������ϡ�����к�����������Һ��ʵ��ʱ���μ�����ǰ���˼���ָʾ�����������жϸ��кͷ�Ӧ���еij̶ȡ���������������Һ������Խ�����̽����
��������룩������Һ���ܳ����ԡ�
���ʵ����֤��IJ��룺
ʵ����� | ʵ������ | ���� |
_____ | _____ | _____ |
��ʵ�����С��ͬѧ��ʵ���������ֻ����������ϡ����������������Һ��Ӧ��pH�仯ͼ�����£�
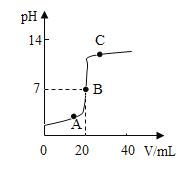
��1��д��ϡ����������������Һ��Ӧ�Ļ�ѧ����ʽ��_____��
��2��������_____���ʾ��ͼ�ǡ����ȫ��Ӧ��
��3��C����Һ�к��е�������_____��
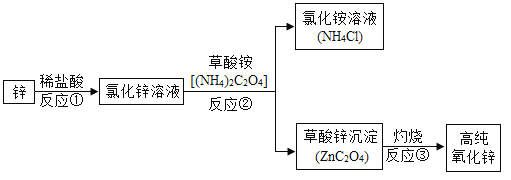
����Ŀ��С���ڿƽ�Ƶ����Ŀ���˽ˮ��ѹ��������һ�����Ͷ���װ�ã�����Ҫԭ����Ӧ�ý���þ����ˮ�ܷ�����ѧ��Ӧ����ôþ��ˮ��Ӧ�Ŀ�������Щ�����й��أ�С����ͬѧ��һ��Դ�չ����̽����
���������ϣ�
���Ȼ������������þ��Ӧ����������ˮ���Ȼ�þ2NH4Cl+Mg(OH)2�TMgCl2+2NH3��+2H2O
��Ũ���������հ������Ҳ������������塣
��������⣩þ��ˮ��Ӧ�Ŀ�������Щ�����й��أ�
���������룩��þ��ˮ��Ӧ�Ŀ��������뷴Ӧ����¶��йء�
��_____________
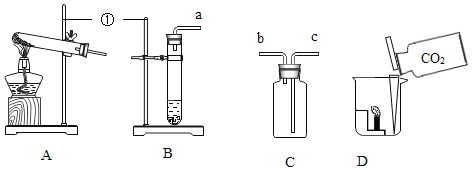
��ʵ��̽����С����֤����ٰ��ռ�ͼװ�ý���ʵ�飨�������ڿɱ����¶Ⱥ㶨��
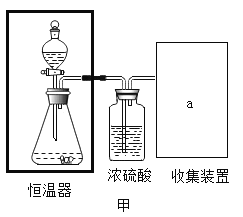
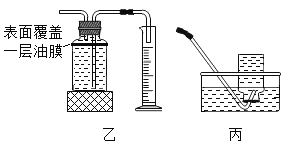
�ڼ�ͼ����ƿ�ͷ�Һ©���У��ֱ���������þ��������ˮ���ı䷴Ӧ���¶ȣ�����¼���±���
��Ӧ���¶ȣ����� | 50 | 55 | 60 | 65 | 70 |
�ռ�50mL��������ʱ�䣨�룩 | 295 | 257 | 196 | 124 | 74 |
����˼���ܽᣩ
��1����ʵ����ͨ���۲�_____________���ж�þ��ˮ��Ӧ�Ŀ�����
��2���ҡ�����ͼ�������ռ�װ�ã���ʵ��a���ռ�װ��Ӧѡ��____________����ѡ���һ�������渲��һ����Ĥ��Ŀ��______________������þ������ˮ��Ӧ����������þ��������ѧ����ʽ___________��
��3��һ��ʱ���С���۲쵽þ����þ������ˮ����ʣ�ࣩ���������ݲ���������Ӧֹͣ�ˡ������������Ȼ����Һ��þ��������ð�����ݣ����ռ�װ���е���������������ӡ����͡�þ����ˮ��Ӧһ��ʱ����ֹͣ���������Ȼ����Һ��þ��ˮ�ķ�Ӧ��������С������ԭ����___________��