题目内容
【题目】在20g溶质质量分数为1.60%的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如图所示. 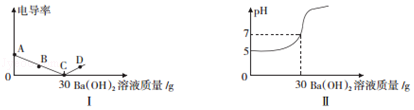
(1)图I中C点所示溶液中,含量较多的微粒有 , D点所示溶液能导电是因为溶液中含有;
(2)计算氢氧化钡溶液的溶质质量分数(写出计算过程).
(3)从图Ⅱ中可知,将足量打磨过的铝片放入上述硫酸铜溶液中,可以观察到的现象是 .
【答案】
(1)H2O;较多的自由移动的Ba2+、OH﹣
(2)解:20mL1.60%的硫酸铜溶液中CuSO4的质量为20mL×1g/cm3×1.60%=0.32 g
设与32 g硫酸铜完全反应需Ba(OH)2的质量为x
CuSO4+ | Ba(OH)2=BaSO4↓+Cu(OH)2 |
160 | 171 |
0.32g | x |
![]()
x=0.342g
氢氧化钡溶液的溶质质量分数为: ![]() ×100%=1.14%
×100%=1.14%
(3)铝片表面有气泡,且表面有红色固体析出,溶液由蓝色变成无色
【解析】解:(1)C点导电性为零,说明所示氢氧化钡和硫酸铜恰好完全反应,生成硫酸钡、氢氧化铜沉淀,C点所示溶液中,含量较多的微粒有:H2O; D点所示所加氢氧化钡溶液过量,溶液能导电是因为溶液中含有较多的自由移动的Ba2+、OH﹣;(3)将打磨过的铝片放入上述该硫酸铜溶液中,从溶液的pH变化分析,一开始溶液显酸性,说明其中含有酸,铝与硫酸铜反应生成硫酸铝和铜,铝与酸反应生成氢气,所以可以观察到的现象是铝片表面有气泡,且表面有红色固体析出,溶液由蓝色变成无色;
答案:(1)H2O;较多的自由移动的Ba2+、OH﹣;(3)Ba(OH)2溶液的溶质质量分数为1.14%.(4)铝片表面有气泡,且表面有红色固体析出,溶液由蓝色变成无色.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】某奶制品的营养成分见表
项目 | 每100mL | NRV% |
能量 | 290kJ | 3% |
蛋白质 | 3.2g | 5% |
脂肪 | 4.0g | 7% |
碳水化合物 | 4.8g | 2% |
钠盐 | 62mg | 3% |
(1)和水也是人体必需的基本营养物质,但在表中未标示.
(2)该奶制品中能够提供能量(任写一种).
(3)奶制品中含有丰富的钙(填“单质”、“原子”或“元素”),儿童每日要摄取足够量的钙,才能避免(填字母序号). a.贫血症 b.佝偻病 c.甲状腺肿大
(4)如图是奶制品的两种包装.其中所使用的主要材料属于有机合成材料的是(填字母序号,下同),属于无机合成材料的是 , 应放入标有  的垃圾箱中的是 .
的垃圾箱中的是 .
(5)下列物质不会使蛋白质失去原有生理活性的是(填字母序号). a.浓硫酸 b.乙酸铅 c.硫酸铵 d.甲醛.