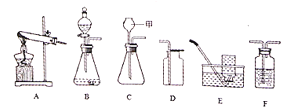
��Ŀ����
����Ŀ��ij��ȤС��Ϊ��֤�����غ㶨�ɣ�����þ���ڿ�����ȼ�յ�ʵ�顣
��1����д��þ����������Ӧ�Ļ�ѧ����ʽ_____��
��2��С������ȼ�ղ�����������ڷ�Ӧ��þ������������Ϊ�����Ӧ�����������غ㶨�ɡ���_____����ͬ����������ͬ������С���Ĺ۵㡣
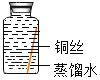
��3��С�찴��ͼװ�øĽ�ʵ�飬��֤�������غ㶨�ɣ�ȴ���ֲ����л���������ɫ���塣
��������⣩��ɫ������ʲô�أ�
���������ϣ�
������þΪ��ɫ����
��þ���뵪����Ӧ���ɻ�ɫ�ĵ���þ��Mg3N2�����壻
�۵���þ����ˮ���ҷ�Ӧ������������������ʹʪ��ĺ�ɫʯ����ֽ������
���������룩��ɫ����ΪMg3N2
ʵ����� | ʵ������ |
___ | ___ |
����˼�뽻����������N2�ĺ���Զ����O2�ĺ�������þ���ڿ�����ȼ�����ɵ�MgOȴԶ����Mg3N2��Ϊʲô������������Ľ���_____��
��4������ȤС����̽������þ�Ļ�ѧ���ʣ��ֽ���������ʵ�飬������þ�����뵽�Ȼ�����Һ�У��۲쵽þ�����������ݲ�����
��������⣩����������ʲô���ʣ�
���������룩����һ����������������������������������������������Ƕ�����̼��
���������ۣ����˼����һ����Ϊ����������������������_____��
��ʵ������ۣ�
ʵ�鲽�� | ���� | ���� |
�������Թ��ռ������壬�ٽ������ǵ�ľ�������Թ� | ����һ������ | |
���ü��쵼�ܽ����嵼������ȼ��ͬʱ���Ϸ���һ�����IJ���Ƭ | ��������ȼ�գ��Ҳ���Ƭ�� ��_____���� | ��������� |
���𰸡�2Mg+O2![]() 2MgO ��ͬ�� ȡ������ɫ�������Թ��У���������ˮ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� �������ݣ�ʪ��ĺ�ɫʯ����ֽ����ɫ ��ͬ�����£�þ������������Ӧ ��Ӧ���в�����̼Ԫ�� ˮ��
2MgO ��ͬ�� ȡ������ɫ�������Թ��У���������ˮ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� �������ݣ�ʪ��ĺ�ɫʯ����ֽ����ɫ ��ͬ�����£�þ������������Ӧ ��Ӧ���в�����̼Ԫ�� ˮ��
��������
��1��þ����������Ӧ��������þ����Ӧ�Ļ�ѧ����ʽΪ��2Mg+O2![]() 2MgO��
2MgO��
���2Mg+O2![]() 2MgO��
2MgO��
��2��С������ȼ�ղ�����������ڷ�Ӧ��þ��������������Ϊ�����е������μ��˷�Ӧ�����������غ㶨�ɡ�
�����ͬ�⣻
��3��[��������]
ȡ������ɫ�������Թ��У���������ˮ����ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ��������ݣ�ʪ��ĺ�ɫʯ����ֽ����ɫ����ɫ�����ǵ���þ��ʵ�����������ʾ��
ʵ����� | ʵ������ |
ȡ������ɫ�������Թ��У���������ˮ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | �������ݣ�ʪ��ĺ�ɫʯ����ֽ����ɫ |
[��˼�뽻��]
������N2�ĺ���Զ����O2�ĺ�������þ���ڿ�����ȼ�����ɵ�MgOȴԶ����Mg3N2������Ϊ��ͬ�����£�þ������������Ӧ��
�����ͬ�����£�þ������������Ӧ��
��4��[��������]���˼����һ����Ϊ���������������������Ƿ�Ӧ���в�����̼Ԫ�أ��������ɶ�����̼��
�����Ӧ���в�����̼Ԫ�ء�
[ʵ�������]
�������Թ��ռ������壬�ٽ������ǵ�ľ�������Թܣ������ǵ�ľ�����ܸ�ȼ��˵�����岻��������
���ü��쵼�ܽ����嵼������ȼ��ͬʱ���Ϸ���һ�����IJ���Ƭ����������ȼ�գ��Ҳ���Ƭ����ˮ����֣�˵��������������ʵ�����������ʾ��
ʵ�鲽�� | ���� | ���� |
�������Թ��ռ������壬�ٽ������ǵ�ľ�������Թ� | �����ǵ�ľ�����ܸ�ȼ | ����һ������ |
���ü��쵼�ܽ����嵼������ȼ��ͬʱ���Ϸ���һ�����IJ���Ƭ | ��������ȼ�գ��Ҳ���Ƭ�� ��ˮ����� | ��������� |

����Ŀ��ij��ѧ��ȤС����ʵ����������غͶ������̻�ϼ�����ȡ����ʱ�������Ƶõ������д̼�����ζ����������ʦ��ָ���¶Ը�����ɷֽ���̽����
��������⡿�������������̻�ϼ��Ⱥ����������ɷ���ʲô��
���������ϡ�
(1)�������������̻�ϼ��Ȳ���������ֻ�Ե�����ʽ���ڣ�
(2)����(Cl2)���д̼�����ζ�����壬������ˮ����ʹʪ��ĵ��۵⻯����ֽ������
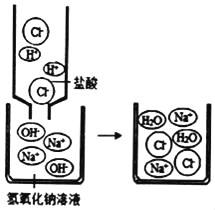
����������衿����һ��������ΪO2���������������ΪCl2����������������Ϊ_____________��
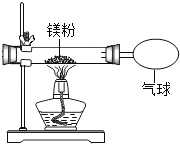
��ʵ��̽����
��� | ʵ����� | ʵ������ | ʵ����� |
1 | С������ˮ�������ռ�A��B��ƿ���壬��������ľ������A�У�ʪ��ĵ��۵⻯����ֽ����B�� | A�д�����ľ����ȼ��B�е��۵⻯����ֽ����ɫ | ����____���� |
2 | С��������ſ������ռ�C��D��ƿ���壬��������ľ������C�У�ʪ��ĵ��۵⻯����ֽ����D�� | C�д�����ľ����ȼ��D�е��۵⻯����ֽ_______ | ���������� |
����˼�����ۡ�
(1)С����ΪС���Ľ��۲���ȷ��ԭ����___________________________��
(2)�����ø����ķ�������Cl2�Ĵ��ڣ��÷�����__________________________________________��
����չӦ�á�
(1)��ȡ����غͶ������̻�ϼ��Ⱥ���������壬��������ˮ�ܽ⣬���ˣ���Һ���Ϻ�ɫ��������˵����Ӧ��������__________(�ѧʽ)��
(2)MnO2����������������������Ӧ�ʵ����ͨ����MnO2��Ũ���Ṳ����ȡCl2������ɸ÷�Ӧ�Ļ�ѧ����ʽ��MnO2+4HCl(Ũ)![]() MnCl2+________+Cl2����
MnCl2+________+Cl2����
����Ŀ��ͭ��Ʒ�ڿ����о��ñ���������ɫ��ͭ�⣨�ֳ�ͭ�̣����ţ�2���ѧʵ��С����Ʋ�����ʵ�飬̽��ͭ�����ɺ�ͭ�����������
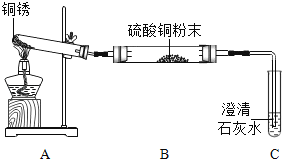
��1��̽��ͭ������
���������ϣ���ͭ�������ֽ⣻������ͭ��ĩ��ˮ�ɰ�ɫ��Ϊ��ɫ��
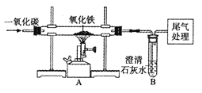
������ʵ�飩С��ͬѧ��ͭ����ȡ�������ĸ���ͭ�⣬����ͼ��ʾװ��ʵ�飨���ּг�װ������ȥ�����۲쵽B�а�ɫ��ĩ��Ϊ��ɫ��C�г���ʯ��ˮ����ǡ�
����������ۣ������������������ͭ����һ�����е�Ԫ����Cu��_____��
��2��̽��ͭ���������
��������룩����ͭ�����ɺ��ڿ����е������Ʋ⣬ͭ���������CO2��H2O��O2�йء�
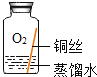
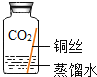
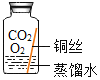
������ʵ�飩ʵ��С��ͬѧȡֱ�������Ⱦ���ͬ��ͭ˿������ĥ���������������ͼ��ʾ��5��ʵ�鲢�����۲졣
��� | A | B | C | D | E |
ʵ�� |
|
|
|
|
|
���� | ���������� | ���������� | ͭ˿���� ����ɫ���� | ���������� | ���������� |
����������ۣ�
��ʵ����ʹ�á�����и�������Ѹ����ȴ������ˮ������Ŀ����_____��
�ڵó���ͭ����һ����CO2�йء��Ľ��ۣ����ݵ�����ʵ����_____�����ţ���
�۶Ա�ʵ��B��C���ó��Ľ�����_____��
��Ϊ��֤�����뽫ʵ��E������������Ӧ���ӵ�ҩƷ��_____��
��������ʵ�����֪��ͭ�����������_____��
��3������˼��Ӧ�ã�
�������ʵ�飬��Ա���ͭ��Ʒ�Ľ�����_____��