题目内容
(2011年福建福州,17题)某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:

①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用简单的方法检查图12所示装置的气密性?
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。

①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用简单的方法检查图12所示装置的气密性?
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。
(1)Mg+ H2SO4= MgSO4+H2↑ (2)不能
(3)把玻璃管下移一段距离,使玻璃管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示漏气。(合理答案均可得分)
(4)80%
(5)否 因为试管中留有的氢气体积等于从试管中排出的空气体积,所以对实验最终结果没有影响。
(3)把玻璃管下移一段距离,使玻璃管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示漏气。(合理答案均可得分)
(4)80%
(5)否 因为试管中留有的氢气体积等于从试管中排出的空气体积,所以对实验最终结果没有影响。
分析:(1)镁与硫酸发生置换反应,反应生成硫酸镁同时放出氢气;
(2)称量0.030g镁需要精确度为0.001g的天平,而托盘天平的精确度一般为0.1g,不能称量0.030g镁带样品;
(3)在不改变温度的情况下,可通过抬高或降低玻璃管内液面而产生压强差而检查该装置的气密性;
(4)根据反应的化学方程式,由产生氢气质量计算镁带中镁的质量,进而计算该镁带中单质镁的质量分数;
(5)根据“同温同压下,不同气体混合后体积等于混合前各气体体积之和”可知,装置内气体体积为空气的体积与生成氢气体积之和,试管内的留有的氢气与排出的空气体积相等,并不影响测定结果.
解答:解:(1)镁与硫酸发生置换反应生成硫酸镁和氢气,反应的化学方程式为Mg+H2SO4═MgSO4+H2↑;
故答案为:Mg+H2SO4═MgSO4+H2↑;
(2)托盘天平只能精确到0.1g,因此不能使用托盘天平称量出0.030g镁;
故答案为:不能;
(3)抬高玻璃管会使装置内气体压强增大而降低玻璃管则会使气体压强减小,通过压强的改变并能维持这种改变,可检查装置的气密性;
故答案为:把玻璃管下移一段距离,使玻璃管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示装置漏气;
(4)设镁的质量为x
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.0020g
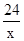 =
=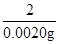
x=0.024g
该镁带中单质镁的质量分数=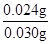 ×100%=80%
×100%=80%
故答案为:80%;
(5)根据“同温同压下,不同气体混合后体积等于混合前各气体体积之和”,留在试管内的氢气排出等体积的空气而使装置内气体体积总和不变,因此,此部分氢气并不影响对产生氢气的体积的测量;
故答案为:否;因为试管中留有的氢气体积等于从试管中排出的空气体积,所以对实验最终结果没有影响.
(2)称量0.030g镁需要精确度为0.001g的天平,而托盘天平的精确度一般为0.1g,不能称量0.030g镁带样品;
(3)在不改变温度的情况下,可通过抬高或降低玻璃管内液面而产生压强差而检查该装置的气密性;
(4)根据反应的化学方程式,由产生氢气质量计算镁带中镁的质量,进而计算该镁带中单质镁的质量分数;
(5)根据“同温同压下,不同气体混合后体积等于混合前各气体体积之和”可知,装置内气体体积为空气的体积与生成氢气体积之和,试管内的留有的氢气与排出的空气体积相等,并不影响测定结果.
解答:解:(1)镁与硫酸发生置换反应生成硫酸镁和氢气,反应的化学方程式为Mg+H2SO4═MgSO4+H2↑;
故答案为:Mg+H2SO4═MgSO4+H2↑;
(2)托盘天平只能精确到0.1g,因此不能使用托盘天平称量出0.030g镁;
故答案为:不能;
(3)抬高玻璃管会使装置内气体压强增大而降低玻璃管则会使气体压强减小,通过压强的改变并能维持这种改变,可检查装置的气密性;
故答案为:把玻璃管下移一段距离,使玻璃管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示装置漏气;
(4)设镁的质量为x
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.0020g
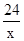 =
=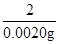
x=0.024g
该镁带中单质镁的质量分数=
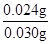 ×100%=80%
×100%=80%故答案为:80%;
(5)根据“同温同压下,不同气体混合后体积等于混合前各气体体积之和”,留在试管内的氢气排出等体积的空气而使装置内气体体积总和不变,因此,此部分氢气并不影响对产生氢气的体积的测量;
故答案为:否;因为试管中留有的氢气体积等于从试管中排出的空气体积,所以对实验最终结果没有影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




 2MgO + C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
2MgO + C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。



