题目内容
某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t3时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
(1)完全反应后产生的氧气的总质量为______.
(2)样品氯酸钾纯度是多少?
【答案】分析:(1)当固体不再减少时,说明完全反应,根据质量守恒定律固体减少的质量就是生成氧气的质量.
(2)由氧气的质量根据氯酸钾分解的化学方程式可以计算出样品中氯酸钾的纯度.
解答:解:(1)生成氧气的质量为
6g-4.08g=1.92g
(2)设样品中氯酸钾的纯度为x.
2KClO3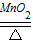 2KCl+3O2↑
2KCl+3O2↑
245 96
(6g-1g)×x 1.92g
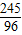 =
= ,x=98%
,x=98%
答:(1)完全反应后产生的氧气的总质量为1.92g.
(2)样品中氯酸钾的纯度为98%.
点评:本题主要考查质量守恒定律和含杂质物质的化学方程式的计算,难度稍大.
(2)由氧气的质量根据氯酸钾分解的化学方程式可以计算出样品中氯酸钾的纯度.
解答:解:(1)生成氧气的质量为
6g-4.08g=1.92g
(2)设样品中氯酸钾的纯度为x.
2KClO3
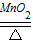 2KCl+3O2↑
2KCl+3O2↑245 96
(6g-1g)×x 1.92g
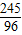 =
= ,x=98%
,x=98%答:(1)完全反应后产生的氧气的总质量为1.92g.
(2)样品中氯酸钾的纯度为98%.
点评:本题主要考查质量守恒定律和含杂质物质的化学方程式的计算,难度稍大.

练习册系列答案
相关题目
某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t3时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
试计算:
(1)完全反应后产生的氧气的总质量为 .
(2)样品氯酸钾纯度是多少?
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
(1)完全反应后产生的氧气的总质量为
(2)样品氯酸钾纯度是多少?
某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应):
试计算:(1)完全反应后产生的氧气的总质量为 .
(2)样品中氯酸钾的纯度是多少?.
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
(2)样品中氯酸钾的纯度是多少?.