题目内容
【题目】FeSO47H2O是一种重要的食品和饲料添加剂。某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(SiO2既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO47H2O的流程如下图
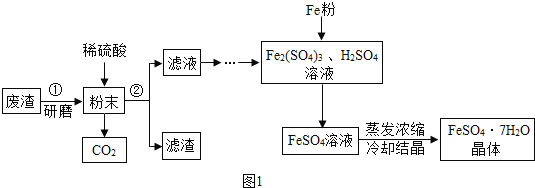
请根据流程图回答下列问题:
(1)稀硫酸与粉末中的氧化铁反应的化学方程式为_____。
(2)操作②所需要的玻璃仪器是:烧杯、玻璃棒和_____。
(3)经测定,滤渣中只含有CaSO4和SiO2,你认为实验室_____(填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳。
(4)Fe与Fe2(SO4)3反应的化学方程式为_____。
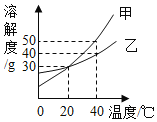
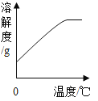
(5)硫酸亚铁的溶解度曲线如图,待结晶完毕后,滤除晶体,用少量冰水洗涤2-3次。用冰水洗涤的目的是:Ⅰ除去晶体表面附着的杂质;Ⅱ_____。
【答案】![]() 漏斗 能
漏斗 能 ![]() 减少FeSO47H2O晶体的损失
减少FeSO47H2O晶体的损失
【解析】
(1)稀硫酸与粉末中的氧化铁反应,生成硫酸铁和水,其反应的化学方程式为:![]() ;
;
(2)由题目中图可以看出步骤②用来分离固体和液体,获得滤液和滤渣,所以这个步骤是过滤;过滤时需用到的仪器有:烧杯、玻璃棒和漏斗;
(3)工业废渣主要成分是![]() ,还含有
,还含有![]() 和
和![]() (既不溶于水也不溶于稀硫酸),加入稀硫酸后,题目中指出:“经测定,滤渣中只含有
(既不溶于水也不溶于稀硫酸),加入稀硫酸后,题目中指出:“经测定,滤渣中只含有![]() 和
和![]() ”;说明废渣中的碳酸钙已经完全和稀硫酸反应,生成了二氧化碳气体,故填:能;
”;说明废渣中的碳酸钙已经完全和稀硫酸反应,生成了二氧化碳气体,故填:能;
(4)由图可知:Fe与![]() 反应生成
反应生成![]() ,反应物是Fe和
,反应物是Fe和![]() ,生成物是
,生成物是![]() ,故反应的化学方程式为:
,故反应的化学方程式为:![]() ;
;
(5)硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,用冰水洗涤的目的是Ⅰ:除去晶体表面附着的溶于水杂质,Ⅱ:冰水的温度低,硫酸亚铁在低温下的溶解度小,减少FeSO47H2O晶体的损失。

【题目】同学们用“硝酸钡、氢氧化钡、碳酸钾”三种物质的溶液进行实验。
(1)甲组同学用______测得碳酸钾溶液的pH大于7,同学们因此推理得知:呈碱性的溶液不一定是碱的溶液。
(2)乙组同学按如图所示进行实验,此时观察到的实验现象是______,请写出其中一个反应的化学方程式________。实验完毕,充分振荡U形玻璃管,将管内的物质过滤。同学们对滤液成分进行了进一步的探究。
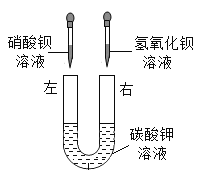
(提出问题)滤液中除K+,还含有什么离子?
(作出猜想)猜想一:含有OH-、NO3-、CO32-
猜想二:含有Ba2+、______(填离子符号)
猜想三:含有OH-、NO3-
(实验探究)
实验操作 | 实验现象 | 结论 |
取滤液于试管中,向其中滴加少量的硫酸钠溶液 | 无明显现象 | 猜想一正确 |
(评价与交流)
(1)你认为乙组同学们的结论________(填“正确”或“不正确”),理由是________。
(2)同学们经过讨论后一致认为:若将硫酸钠溶液换成足量的________,就能确定滤液中的离子成分。