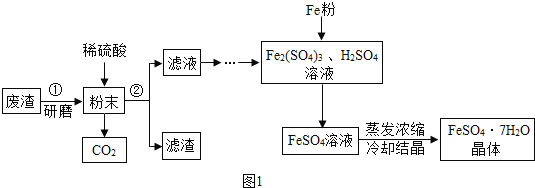
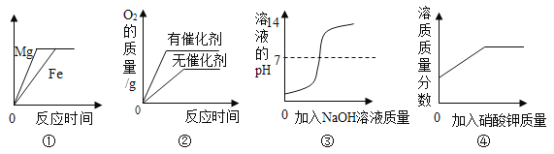
题目内容
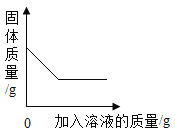
【题目】某化学兴趣小组为测定实验室中氢氧化钡溶液的溶质质量分数,进行了如图所示的实验:
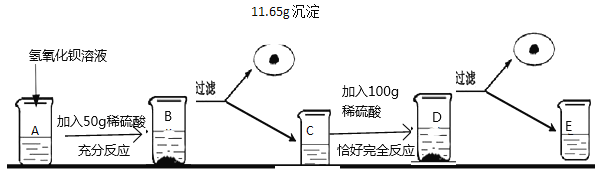
请回答下列问题:
(1)请写出发生反应的化学方程式_____;
(2)请根据已知条件列出第一次加入稀硫酸时,参加反应的氢氧化钡质量(X)的比例式为_____;
(3)用98%的浓硫酸配制上述实验中所用的稀硫酸,需要浓硫酸的质量为_____;
(4)第二次加入100g稀硫酸后反应生成沉淀的质量为_____;
(5)E烧杯中物质的化学式为_____;
(6)若最终称量E烧杯中物质的质量为615.05g,则氢氧化钡溶液中溶质的质量分数为_____。
【答案】![]()
![]() 5g 23.3g H2O 5.1%
5g 23.3g H2O 5.1%
【解析】
(1)氢氧化钡和稀硫酸发生反应的化学方程式为![]() ;
;
(2)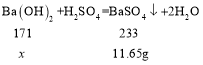 可得第一次加入稀硫酸时,参加反应的氢氧化钡质量(X)的比例式为
可得第一次加入稀硫酸时,参加反应的氢氧化钡质量(X)的比例式为![]() ;
;
(3)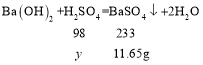 可得硫酸的质量为
可得硫酸的质量为![]() 浓硫酸的质量为
浓硫酸的质量为![]()
(4)第一次加入50g稀硫酸完全反应沉淀为11.65g,第二次加入同样的稀硫酸100g,完全反应按照比例沉淀质量为23.3g。
(5)C到D完全反应,即发生完全中和反应,因此D烧杯过滤之后的E烧杯只有水,化学式为H2O。
(6)第一次反应的氢氧化钡为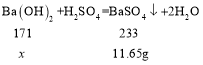
![]()
第二次反应的氢氧化钡为原来的一倍为8.55g×2=17.1g。
因此氢氧化钡总量为8.55g+17.1g=25.65g
而溶液中的水为615.05g-45g-90g=480.05g
则氢氧化钡溶液中溶质的质量分数为![]()

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目