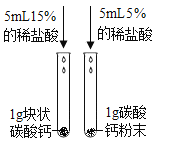
题目内容
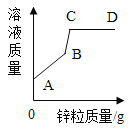
【题目】a、b、c三种固体物质的溶解度曲线如图,请据图回答下列问题。
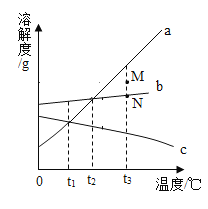
(1) t1°C时三种物质的溶解度由小到大的顺序是_____。
(2)b中含有少量a时,为了提纯b,可采用的方法是_____。
(3)将M点的b溶液转变为N点的b溶液的方法是_____。
(4)现有t3°C时等质量的三种物质的饱和溶液,当降温至t2°C时,析出晶体的质量大小关系为_____。
【答案】c=a<b 蒸发结晶 加适量溶剂(或过滤) a>b>c
【解析】
(1)由溶解度曲线可知,在同一温度下,纵坐标值越大,溶解度越大,所以,t1°C时三种物质的溶解度由小到大的顺序是c=a<b。
(2)a 物质的溶解度受温度变化影响较大,b物质的溶解度受温度的变化影响较小,所以,当b中含有少量a时,为了提纯b,可采用的方法是蒸发结晶。
(3)M点在物质b的溶解度曲线上方,表示的是t3°C时b物质的过饱和溶液,而N点在b物质的溶解度曲线上,表示的是t3°C时b物质的饱和溶液(无固体剩余),加适量溶剂或过滤可将M点的b溶液转变为N点的b溶液。
(4)将t3°C时等质量的三种物质的饱和溶液降温至t2°C,物质a溶解度受温度影响比b大,析出晶体较多,而物质c的溶解度随温度的升高而减小,所以降温后c无晶体析出,即析出晶体质量a>b>c。

【题目】下列实验操作或结论合理的是
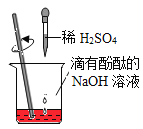
A.区分两种常见氮肥氯化铵和硫酸铵,可以通过取样,分别加入少量熟石灰,研磨分辨
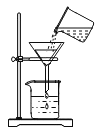
B.除去二氧化锰中的氯化钾,可以通过加水溶解、过滤、蒸发的实验操作达到目的
C.Ca(NO3)2、Na2CO3、NaCl、HNO3不另加试剂就不能将它们区别开来
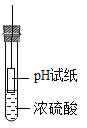
D.在如下图所示的几个实验操作中,错误的操作为②③④
|
|
|
|
①探究酸碱中和 | ②过滤操作 | ③测某浓度浓硫酸的pH | ④探究反应物接触面积对反应速率的影响 |
【题目】实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫各小组开展探究。

(提出问题)
这瓶无色溶液究竟是什么物质的溶液?
(猜想与假设)
经了解得知,这瓶无色溶液原来是放在存放盐溶液的柜子里。由此猜测:可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种。
(理论分析)
为了确定该溶液,他们首先进行了
(1)甲同学根据标签上的组成元素认为一定不可能是_____溶液。
(2)乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是_____。
(设计实验)
为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验:
实验操作 | 实验现象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,倒出上层清液,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀消失 |
(实验结论)
(3)该瓶无色溶液是_____。
(实验反思)
(4)丙同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实验操作 | 实验现象 |
_____ | _____ |
(5)下列物质能与Na2CO3溶液反应产生与步骤①类似实验现象的是_____。
A Ba(OH)2 B CaCl2 C KNO3 D H2SO4