题目内容
【题目】请结合下列实验常用装置,回答有关问题.
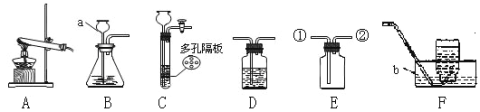
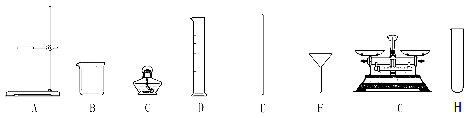
(一)(1)若用B、F组成制取某气体的装置,写出制取此气体的化学方程式为 ,若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放 试剂(填写试剂名称).如果用E装置收集该气体则气体从 端进入(填“①”或“②”)。
(2)乙炔(C2H2)是无色、无味、易燃的气体,乙炔的密度比空气略小,难溶于水。乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体)与水反应生成,同时生成一种白色固体。已知碳化钙与水反应非常剧烈。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 。
(二)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
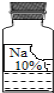
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度g | 36 | 109 | 215 | 9.6 |
小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量溶液于试管中,滴加 | 产生大量气泡 | 反应的化学方程式: |
② 把产生的气体通入澄清的石灰水中. | 澄清的石灰水变浑浊 | 猜想②正确. 反应的化学方程式: |
【答案】(一)(1)2H2O2![]() 2H2O+O2↑;浓硫酸①(2)CF
2H2O+O2↑;浓硫酸①(2)CF
(二)【交流讨论】A【查阅资料】NaHCO3【作出猜想】NaOH【实验探究】(1)NaCl溶液(2)①稀盐酸Na2CO3+2HCl=2NaCl+H2O+CO2↑ ②CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
试题分析:用B、F组成制取某气体的装置,写出制取此气体的化学方程式为2H2O2![]() 2H2O+O2↑;若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放浓硫酸。利用浓硫酸来干燥气体,如果用E装置收集该气体则气体从①进入,因为密度大的走长管,实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的发生装置是C,因为过程中不加热,所以不选A,因为更好的控制反应,应该用C而不用B,因为B不能随时发生、随时停止;根据受损标签的情况判断,这瓶试剂不可能是酸,因为酸中不能含有金属元素,小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是NaHCO3,因为碳酸氢钠的溶解度只有9.6克,【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是氢氧化钠,用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是NaCl溶液,因为氯化钠显示中性,PH等于7;碳酸钠和氢氧化钠的区分可以用稀盐酸,因为碳酸钠遇到盐酸会产生气泡,而氢氧化钠则不会;反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;也可以加入澄清的石灰水,因为氢氧化钙会和碳酸钠反应产生白色的沉淀,反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O。
2H2O+O2↑;若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放浓硫酸。利用浓硫酸来干燥气体,如果用E装置收集该气体则气体从①进入,因为密度大的走长管,实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的发生装置是C,因为过程中不加热,所以不选A,因为更好的控制反应,应该用C而不用B,因为B不能随时发生、随时停止;根据受损标签的情况判断,这瓶试剂不可能是酸,因为酸中不能含有金属元素,小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是NaHCO3,因为碳酸氢钠的溶解度只有9.6克,【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是氢氧化钠,用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是NaCl溶液,因为氯化钠显示中性,PH等于7;碳酸钠和氢氧化钠的区分可以用稀盐酸,因为碳酸钠遇到盐酸会产生气泡,而氢氧化钠则不会;反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;也可以加入澄清的石灰水,因为氢氧化钙会和碳酸钠反应产生白色的沉淀,反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O。

 名校课堂系列答案
名校课堂系列答案