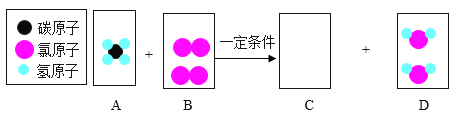
题目内容
【题目】某工业废液中含有CuSO4、ZnSO4、FeSO4,如果将废液直接排放就会造成水污 染。于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
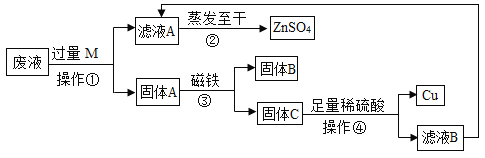
请回答:
(1)操作①的名称是_______,其中玻璃棒的作用是______。写出加过量M发生的一个化学反应的方程式____________________。
(2)固体A中一定有_______。判断操作④中稀硫酸足量的方法是_______。
(3)滤液 A、滤液B合起来蒸发至干目的是_________________。
【答案】过滤 引流 Zn+CuSO4=ZnSO4+Cu 或Zn+FeSO4=ZnSO4+Fe Zn、Fe、Cu 继续加稀硫酸,无气泡生成 提高硫酸锌的产率
【解析】
(1)操作1是将固体和液体分离的过程,故名称是过滤。过滤操作中玻璃棒的作用是引流。锌与硫酸铜反应生成硫酸锌和铜,锌与硫酸亚铁反应生成铁和硫酸锌,故反应的方程式为:Zn+CuSO4=ZnSO4+Cu 或Zn+FeSO4=ZnSO4+Fe。
(2)由图可知,加入的M物质是过量的锌,锌可以与CuSO4、FeSO4反应生成铜和铁和硫酸锌,与ZnSO4不反应,故固体A中一定有Zn、Fe、Cu。如酸不足则不能与金属反应,则可以继续加热稀硫酸,如没有气泡没冒出,则说明稀硫酸足够。
(3)由图可知,固体C是不能被磁铁吸引,故C中含有铜和锌,故滤液B中的溶质是硫酸锌,故与滤液A混合蒸干可以提高硫酸锌的产率

【题目】学习了碳酸钠的性质后,小莹和小雨各取三支试管做了如下实验。
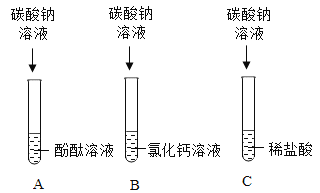
(1)试管A中酚酞溶液变为红色,说明碳酸钠溶液显_____性。
(2)试管B中的实验现象为_____。
(3)试管C中发生反应的化学方程式为_____。
实验结束后,小莹和小雨将各自三支试管中的物质分别倒入①号、②号烧杯中,静置一段时间后观察到如下实验现象,请
编号 | 实验现象 | 实验分析 |
①号烧杯 | 溶液呈红色,且有白色沉淀 | 溶液中的溶质一定有_____(填除指示剂外的全部溶质,下同) |
②号烧杯 | 溶液呈无色,没有白色沉淀 | 溶液中的溶质一定有_____,可能有HCl |
为了确定②号烧杯中可能含有的溶质是否存在,小雨同学继续进行探究。
(实验验证)
取②号烧杯中的溶液于试管中,加入锌粒后,观察到_____,说明溶质中含有HCl。
(讨论交流)
下列试剂中可以代替锌粒达到探究目的的是_____(填字母序号)。
A Fe2 O3 B CO2 C Cu
(实验反思)
两位同学讨论后一致认为,两烧杯中出现不同现象的原因是反应物的用量不同。
【题目】(1)某物质R完全燃烧的化学方程式为:2R+3O2![]() 2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
(2)在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中不正确的是_____。
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质质量/g | 8 | 32 | 5 | 4 |
反应后物质质量/g | 16 | 4 | x | 24 |
A 该反应为分解反应
B 甲、乙两种物质间参加反应的质量比为1:4
C 丙可能为该反应的催化剂
D 乙、丁两种物质间反应的质量比为7:5