题目内容
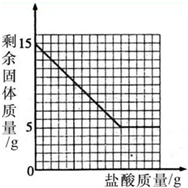 为了测定石灰石中碳酸钙的含量,将粉碎后的15g石灰石样品(样品中杂质不溶于水,且不与酸反应)放入烧杯中,然后加入足量的盐酸完全反应.烧杯中剩余固体质量与加入盐酸质量的关系如图所示.请计算:
为了测定石灰石中碳酸钙的含量,将粉碎后的15g石灰石样品(样品中杂质不溶于水,且不与酸反应)放入烧杯中,然后加入足量的盐酸完全反应.烧杯中剩余固体质量与加入盐酸质量的关系如图所示.请计算:
(1)该石灰石样品中碳酸钙的质量分数(计算结果保留一位小数).
(2)如果盐酸的质量分数为7.3%,求恰好反应时盐酸的质量.
该石灰石样品中碳酸钙的质量分数
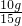 ×100%=66.7%
×100%=66.7% (2)设恰好反应时,氯化氢的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73
10g x
根据:
 解得x=7.3g.
解得x=7.3g. 恰好反应时盐酸的质量=
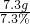 =100g
=100g 答:该石灰石样品中碳酸钙的质量分数为66.7%;恰好反应时盐酸的质量为100g.
故答案为:(1)66.7%;(2)100g.
分析:根据图示可知固体质量的减少量就是参加反应的碳酸钙质量,根据碳酸钙的质量除以石灰石样品的质量乘以百分之百,根据碳酸钙质量算出氯化氢的质量,再除以7.3%即可.
点评:解答本题关键是要知道固体质量减少的原因是碳酸钙与盐酸反应了,所以固体质量减少了多少,参加反应的碳酸钙的质量就是多少,根据碳酸钙的质量再进一步进行计算即可.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案.(10分)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(1)很多品牌牙膏都标有“含氟”字样,其中的“氟”是指
A.氟单质 B.氟元素 C.氟原子
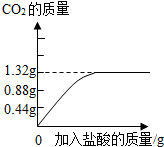
(2)牙膏去污主要是利用了摩擦作用。某品牌牙膏中的摩擦剂是碳酸钙,为了检验并测定牙膏中碳酸钙的质量分数,同学们取了10g牙膏,加入足量稀盐酸并搅拌。实验过程中记录并处理数据形成下图曲线:
该品牌牙膏中碳酸钙的质量分数为多少。
(3)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如下:
①“煅烧炉”中发生反应的化学方程式是: ,在“反应池”中主要发生反应的化学方程式是: 。
②“沉淀池”中生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆,熟石灰浆为
(选填“悬浊液”或“溶液”或“乳浊液”)。
③有人建议在上述流程中用CO2替代“碳酸钠溶液”。这样做的优点是 。
小王查阅资料后得知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应: CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+ H2O + CO2=Ca(HCO3)2;
|
2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(1)很多品牌牙膏都标有“含氟”字样,其中的“氟”是指
A.氟单质 B.氟元素 C.氟原子
(2)牙膏去污主要是利用了摩擦作用。某品牌牙膏中的摩擦剂是碳酸钙,为了检验并测定牙膏中碳酸钙的质量分数,同学们取了10g牙膏,加入足量稀盐酸并搅拌。实验过程中记录并处理数据形成右图曲线:
该品牌牙膏中碳酸钙的质量分数为多少。

|
|
|
 |
①“煅烧炉”中发生反应的化学方程式是: ,在“反应池”中主要发生反应的化学方程式是: 。
②“沉淀池”中生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆,熟石灰浆为
(选填“悬浊液”或“溶液”或“乳浊液”)。
③有人建议在上述流程中用CO2替代“碳酸钠溶液”。这样做的优点是 。
小王查阅资料后得知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+ H2O + CO2=Ca(HCO3)2;
|
Ca(HCO3)2===== CaCO3↓+H2O+ CO2↑;
为了防止利用该法制得的轻质碳酸钙中混有Ca(HCO3)2,操作2中必需要进行的一步操作是 。
 (2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知: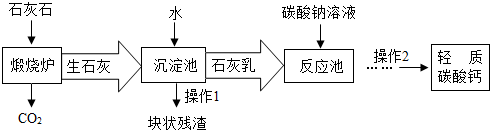
 2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
 CaCO3↓+H2O+CO2↑;
CaCO3↓+H2O+CO2↑;