题目内容
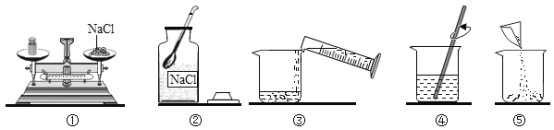
【题目】以下是初中化学的一些基本实验:
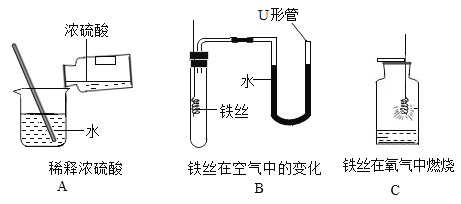
(1)A中玻璃棒的作用是_____;
(2)一段时间后,B中的实验现象为_____;
(3)C实验中集气瓶内预先装少量水的目的是_____。
【答案】搅拌,使产生的热量迅速扩散 铁丝生锈,U型管内a端上升b端下降 防止生成的高温熔融物溅落瓶底,使瓶底炸裂
【解析】
(1)稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中。A中玻璃棒的作用是搅拌,使产生的热量迅速扩散。
(2)铁与试管中的氧气、水蒸气反应,生成铁锈,一段时间后,由于消耗了装置中的气体,使试管内压强减小,B中的实验现象为铁丝生锈,U型管内a端上升b端下降。
(3)铁丝在氧气中燃烧时,放出大量的热,生成物的温度较高。为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙。

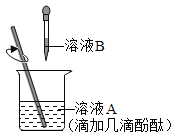
【题目】金属镁可与热水反应生成氢氧化镁和氢气: ![]() 所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
[查阅资料]溶液红色褪去的原因是溶液碱性减弱。
[提出问题]导致溶液碱性减弱的原因是什么?
[假设与分析]
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的________________。
假设3:可能是氢氧化镁的溶解度随温度的降低而________________。
由碱的性质可知,假设1不成立。
[实验探究]
实验操作 | 实验现象 | 结论 |
1.取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | ①______ | 假设2成立 |
2.取上述红色溶液,②________,③__________观察现象。 | 红色褪去 | 假设3成立 |
[拓展延伸]
(1)将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。分析原因是其中发生了两步化学反应:.①![]() ,②______(请写出该步反应的化学方程式)。
,②______(请写出该步反应的化学方程式)。
(2)除上述金属外,根据金属活动性顺序,预测_________也能跟硫酸铜溶液反应产生上述现象(举一例即可)。