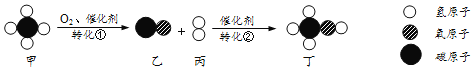
题目内容
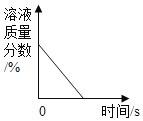
【题目】向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如图所示。请按要求回答问题:
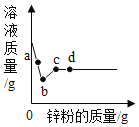
(1)a点所得溶液中所含阳离子是________(填化学符号);
(2)a、b、c、d四点所得的固体中,含有相同物质的是________(填字母序号)。
【答案】Zn2+、Cu2+、Ag+ ab
【解析】
由于锌比铜活泼,铜比银活泼,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入锌粉,锌先和硝酸银反应,如果反应后锌过量,则再和硝酸铜反应;
锌和硝酸银、硝酸铜反应的化学方程式及其质量关系为:
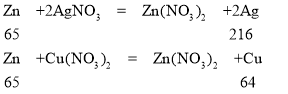
由以上质量关系可知,锌和硝酸银反应后溶液质量减小,和硝酸铜反应后溶液质量增大,即从开始反应至b点时,是锌和硝酸银反应,b-c点时是锌和硝酸铜反应,d是锌过量。
(1)由以上分析可知,a点时锌和部分硝酸银反应,溶液中的溶质有:反应生成的硝酸锌、剩余的硝酸银和没有反应的硝酸铜,所以溶液中存在的阳离子有:Zn2+、Cu2+、Ag+;
(2)a、b、c、d四点所得的固体中,a、b含有相同物质的是银。

【题目】人类的生产、生活离不开水和溶液。
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有_________作用。
(2)现有软水和硬水样品各一瓶,请设计实验对它们进行区分,并完成实验报告。
实验步骤 | 实验现象及结论 |
____ | ____ |
(3)下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
下列说法正确的是_________(填字母)。
A 氯化钠的溶解度大于硝酸钾的溶解度
B 20℃时,将30g氯化钠加入50 g水中,充分搅拌,所得溶液中溶质的质量分数为37.5%
C 分别将80℃时硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大
D 从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法
(4)下图是一定溶质质量分数的氯化钠溶液的配制流程。
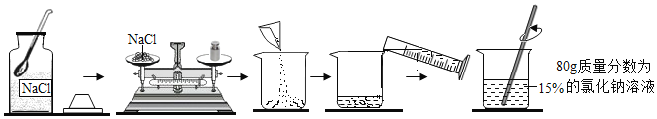
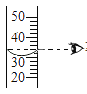
①实验步骤依次为:_________、称量、量取、溶解。用量筒量取所需的水时,若采用仰视的方法读数,配制的氯化钠溶液中溶质的质量分数会_________(填“偏大”或“偏小”)。
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为_________。
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是_______________________。