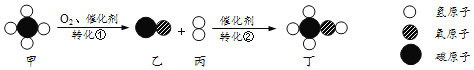
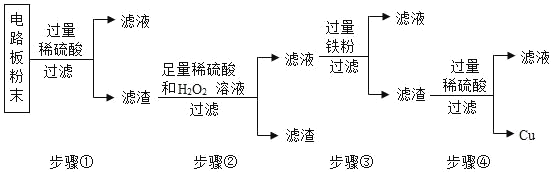
题目内容
【题目】现有300g的AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,过滤后,向滤渣中再加入一定质量分数的稀硫酸,反应图像如图所示,下列说法正确的是
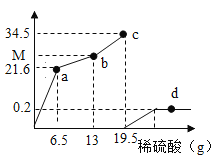
A.b点中溶液的溶质有Cu(NO3)2和Zn(NO3)2
B.m的值为28.0
C.c点中Zn(NO3)2的质量为56.4g
D.d点中含有的固体只有Cu和Ag
【答案】BD
【解析】
分析图象可知,0-a线段代表的是锌与硝酸银反应,a-b线段代表的是锌与硝酸铜反应,b-c线段代表加入过量锌的质量。
A、b点表示硝酸铜与锌完全反应,溶液的溶质没有Cu(NO3)2,只有Zn(NO3)2,不符合题意;
B、由图象可知,参与硝酸铜的锌的质量为![]() , 设生成铜的质量为X,
, 设生成铜的质量为X,
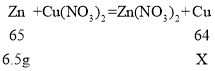

所以m的值为21.6 +6.4=28.0,符合题意;
C、b点表示硝酸铜与锌完全反应,300g的AgNO3和Cu(NO3)2的混合溶液一共消耗锌的质量是13 g ,设一共生成Zn(NO3)2的质量为Y。则:
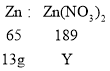
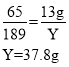
c点中Zn(NO3)2的质量为37.8 g,不符合题意;
D、d点表示固体混合物中的锌已反应完,所以固体混合物中只含有Cu和Ag,符合题意。故选BD。

练习册系列答案
相关题目