题目内容
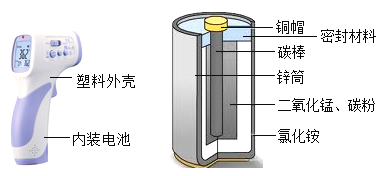
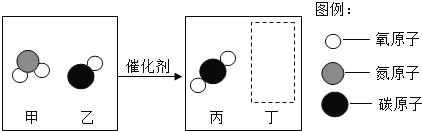
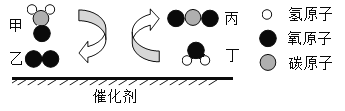
【题目】《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”。反应区中发生的主要反应有:ZnCO3分解生成 ZnO 和另一种氧化物;ZnO与C反应生成Zn。
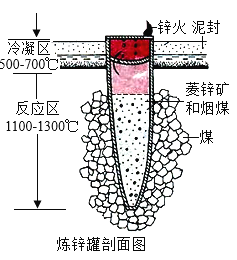
(1)反应区中ZnCO3分解的化学方程式为____________。
(2)“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因_________。
【答案】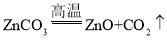 防止生成的锌在较高温度下又被氧化成氧化锌
防止生成的锌在较高温度下又被氧化成氧化锌
【解析】
(1)依据反应区中,ZnCO3分解生成ZnO和另一种氧化物,则碳酸锌在高温的条件下生成氧化锌和二氧化碳,化学方程式为: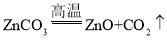 ;
;
(2)冷定”后方能“毁罐“取锌,是为了防止生成的锌在较高的温度下又被氧化成氧化锌。

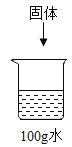
【题目】已知:20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g。配制20℃时的如下四种溶液:
| 溶液 | ① | ② | ③ | ④ |
固体种类 | KCl | KCl | KNO3 | KNO3 | |
加入固体的质量/g | 20 | 35 | 20 | 35 | |
水的质量/g | 100 | 100 | 100 | 100 |
下列有关溶液①~④的说法不正确的是
A.属于饱和溶液的是②④
B.溶液的质量②=④
C.溶液中溶质的质量分数①=③
D.②中溶质与溶剂的质量比为17:50
【题目】阅读下面科普短文。
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物。其实你真的了解SO2吗?难道它只是有害物质吗?
SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业。葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用SO2进行脱色。按照我国《食品添加剂使用标准(GB2760—2014)》,合理使用SO2不会对人体健康造成危害。
标准中部分食品SO2的最大残留量
食品 | 蜜饯 | 葡萄酒 | 食糖 | 水果干 | 巧克力 | 果蔬汁 |
最大残留量 | 0.35g/kg | 0.25g/L | 0.1g/kg | 0.1g/kg | 0.1g/kg | 0.05g/kg |
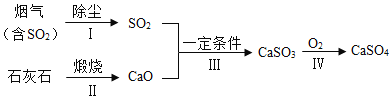
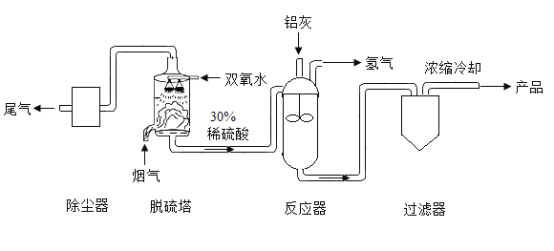
SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步骤是SO2的获取和转化。工业利用硫制硫酸的主要过程示意如下:
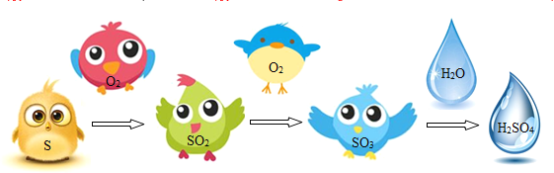
硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水吸收,再用硫酸处理,将重新生成的SO2循环利用。
SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2。为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施,例如,北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量。
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2还会有更全面的认识!
依据文章内容回答下列问题。
(1)按照国家标准,食糖中的SO2最大残留量为____________ g/kg。
(2)葡萄酒酿制过程中SO2的作用是_________。
(3)用硫制硫酸的主要过程中,涉及到的含硫物质有S、_________和H2SO4。
(4)硫酸工业生产中,用SO3与水反应生产硫酸,发生反应的化学方程式为:_________;尾气中含有SO2气体污染空气,工业上可用___________处理尾气。
(5)下列措施能减少SO2排放的是__________(填序号)。
A 将煤块粉碎
B 对燃煤进行脱硫
C 推广煤改气、煤改电
D 循环利用工业尾气中的SO2