题目内容
硬水受热后会产生水垢,水垢的主要成分是CaCO3和Mg(OH)2,其它成分不参与反应.实验室由水垢制取纯净CaCl2固体的流程如下:
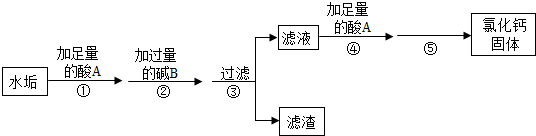
请按要求填空:
(1)酸A是人体胃酸的主要成分,酸A的化学式是 ;
(2)步骤②中生成沉淀的化学反应方程式是 ;
(3)步骤④加酸A的作用是 ;
(4)步骤⑤是利用 的方法得到氯化钙固体.

请按要求填空:
(1)酸A是人体胃酸的主要成分,酸A的化学式是
(2)步骤②中生成沉淀的化学反应方程式是
(3)步骤④加酸A的作用是
(4)步骤⑤是利用
考点:物质的相互转化和制备,酸的物理性质及用途,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据人体胃酸的主要成分是盐酸,所以酸A是盐酸进行分析;
(2)根据氢氧化钙溶液和氯化镁反应生成氢氧化镁白色沉淀和氯化钙进行分析;
(3)根据需要制取的是氯化钙和加入的过量碱B进行分析;
(4)根据滤液中加入酸A后的溶液成分进行分析.
(2)根据氢氧化钙溶液和氯化镁反应生成氢氧化镁白色沉淀和氯化钙进行分析;
(3)根据需要制取的是氯化钙和加入的过量碱B进行分析;
(4)根据滤液中加入酸A后的溶液成分进行分析.
解答:解:(1)人体胃酸的主要成分是盐酸,所以酸A是盐酸,化学式为:HCl;
(2)碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳、氢氧化镁和盐酸反应生成氯化镁和水,最后需要制取氯化钙,所以需要将氯化镁沉淀,依据除杂原则可知,B是氢氧化钙,所以步骤②中生成沉淀的反应是氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;
(3)前面加入的是过量的氢氧化钙,而最后要得到氯化钙,需要将氢氧化钙除去,所以步骤④加酸A的作用是将反应剩余的氢氧化钙除去;
(4)滤液中加入盐酸反应后是盐酸和氯化钙的混合物,所以要从溶液中得到氯化钙,需要用蒸发结晶的方法.
故答案为:(1)HCl;
(2)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;
(3)将反应剩余的氢氧化钙除去;
(4)蒸发结晶.
(2)碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳、氢氧化镁和盐酸反应生成氯化镁和水,最后需要制取氯化钙,所以需要将氯化镁沉淀,依据除杂原则可知,B是氢氧化钙,所以步骤②中生成沉淀的反应是氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;
(3)前面加入的是过量的氢氧化钙,而最后要得到氯化钙,需要将氢氧化钙除去,所以步骤④加酸A的作用是将反应剩余的氢氧化钙除去;
(4)滤液中加入盐酸反应后是盐酸和氯化钙的混合物,所以要从溶液中得到氯化钙,需要用蒸发结晶的方法.
故答案为:(1)HCl;
(2)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;
(3)将反应剩余的氢氧化钙除去;
(4)蒸发结晶.
点评:本题难度不是很大,主要考查了酸的有关的化学性质及有关的化学方程式的书写,培养学生抓住规律、应用规律解决问题的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
最近全国多个城市发生了人感染H7N9禽流感疫情,目前治疗H7N9禽流感最有效的药是帕拉米韦(化学式为C15H28N4O4).下列关于帕拉米韦说法不正确的是( )
| A、帕拉米韦是有机化合物 |
| B、帕拉米韦是由碳、氢、氮、氧四种原子组成 |
| C、帕拉米韦中碳、氢、氮、氧原子个数比为15:28:4:4 |
| D、帕拉米韦中氮元素的质量分数为17.1% |
下列生活用品由有机合成材料制成的是( )
A、 塑料脸盆 |
B、 不锈钢龙头 |
C、 木桶 |
D、 纯棉毛巾 |
某化学兴趣小组的同学设计了探究Fe、Cu、Ag三种金属活动性顺序的四组方案,你认为不可行的是( )
| A、在两只试管中各装少许的CuSO4溶液,分别加入铁片和银片 |
| B、在两只试管中各装少许的FeSO4溶液,分别加入铜片和银片 |
| C、在盛有FeSO4溶液和AgNO3溶液的两只试管中分别加入铜片 |
| D、向盛稀盐酸的两只试管中分别加入铁片和铜片,再向盛有AgNO3溶液的试管中加入铜片 |
下列说法正确的是( )
| A、浓硫酸露置在空气中溶质的质量分数会变大 |
| B、打开装有浓盐酸的试剂瓶,瓶口会有白雾 |
| C、用稀盐酸除去NaOH溶液中的Na2CO3 |
| D、通过溶解、过滤的方法除去生石灰中的碳酸钙 |
 铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.
铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.