题目内容
某化学兴趣小组的同学设计了探究Fe、Cu、Ag三种金属活动性顺序的四组方案,你认为不可行的是( )
| A、在两只试管中各装少许的CuSO4溶液,分别加入铁片和银片 |
| B、在两只试管中各装少许的FeSO4溶液,分别加入铜片和银片 |
| C、在盛有FeSO4溶液和AgNO3溶液的两只试管中分别加入铜片 |
| D、向盛稀盐酸的两只试管中分别加入铁片和铜片,再向盛有AgNO3溶液的试管中加入铜片 |
考点:金属活动性顺序及其应用
专题:金属与金属材料
分析:根据金属活动顺序进行思考,Fe、Cu、Ag这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.所以可以选择相应的金属和盐或酸溶液进行反应来证明这三种金属的活动性强弱.
解答:解:A、铁可以置换CuSO4溶液中的铜而出现红色固体,证明铁的活动性比铜强,银和CuSO4溶液不反应,证明铜比银的活动性强,因此,可以证明三种金属的活动性强弱,故A可行.
B、因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,故B不可行.
C、铜与FeSO4溶液不反应,证明铁的活动性比铜强;铜与AgNO3溶液能反应,证明铜比银的活动性强,故C可行.
D、向盛稀盐酸的两只试管中分别加入铁片和铜片,铁与稀盐酸反应铜不能反应,说明的铁的活泼性大于铜;再向盛有AgNO3溶液的试管中加入铜片,铜能将银从其盐溶液中置换出来.说明了铜的活泼性大于银,能比较三种金属的活泼性.故D可行.
故选B.
B、因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,故B不可行.
C、铜与FeSO4溶液不反应,证明铁的活动性比铜强;铜与AgNO3溶液能反应,证明铜比银的活动性强,故C可行.
D、向盛稀盐酸的两只试管中分别加入铁片和铜片,铁与稀盐酸反应铜不能反应,说明的铁的活泼性大于铜;再向盛有AgNO3溶液的试管中加入铜片,铜能将银从其盐溶液中置换出来.说明了铜的活泼性大于银,能比较三种金属的活泼性.故D可行.
故选B.
点评:同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
下列说法不正确的是( )
| A、原子概念中的“最小”是指,原子在化学变化中不可再分 |
| B、分子概念中的“最小”是指,分子如果再分就不能保持该物质的化学性质了 |
| C、催化剂在反应前后本身的质量和化学性质都没有发生改变 |
| D、合金是指由两种或两种以上的金属通过一定的化学变化而合成的物质 |
对分子、原子、离子、元素的认识不正确的是( )
| A、不同元素的本质区别是质子数不同 |
| B、原子都是由质子、中子和电子构成 |
| C、在办公室吸食“二手烟”原因是分子在不停地运动 |
| D、离子中质子数一定不等于核外电子数 |
对下列各主题知识的认识完全正确的是( )
| A.生活常识 | B.能源与环境 |
| 人体缺铁--引 起贫血 油锅着火--用水浇灭 | 生 活污水--处理后排放 使用化石燃料--无污染 |
| C.性质与用途 | D.物质的鉴别 |
| 活性炭具有吸附性--用于水的净化 一氧化碳具有还原性--用于冶炼金属 | 纯碱溶液和烧碱溶液--酚酞试液 羊毛和涤纶--燃烧 |
| A、生活常识 | B、能源与环境 |
| C、性质与用途 | D、物质的鉴别 |
江南素有“鱼米之乡”之美誉,盛产鱼类和水稻.江南传统主食米饭为人体提供的主要营养是( )
| A、油脂 | B、糖类 |
| C、蛋白质 | D、维生素 |
 2013年12月2日1时30分,我国成功将“嫦娥三号”探测器发射升空.“玉兔号”月球车的结构件材料为我国自主研制的新型镁合金材料.新型镁合金属于( )
2013年12月2日1时30分,我国成功将“嫦娥三号”探测器发射升空.“玉兔号”月球车的结构件材料为我国自主研制的新型镁合金材料.新型镁合金属于( )| A、混合物 | B、纯净物 |
| C、单质 | D、化合物 |
下列表示组成某种稀有气体的原子结构示意图是( )
A、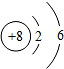 |
B、 |
C、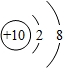 |
D、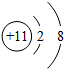 |
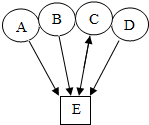 A、B、C、D、E是由H、C、O、Cl、Na、Ca组成的五种初中常见化合物,其中A、B、C、D各代表酸、碱、盐和氧化物中的一种物质通常情况下E是生活中一种常见的无色液体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应用“→”表示一种物质能转化为另一种物质.请回答下列问题:
A、B、C、D、E是由H、C、O、Cl、Na、Ca组成的五种初中常见化合物,其中A、B、C、D各代表酸、碱、盐和氧化物中的一种物质通常情况下E是生活中一种常见的无色液体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应用“→”表示一种物质能转化为另一种物质.请回答下列问题: