��Ŀ����
��10�֣��Ե��ʳ��ˮΪ������ȡ�������������ƵȲ�Ʒ�Ĺ�ҵ��Ϊ���ȼҵ��������Ŀǰ��ѧ��ҵ����Ҫ֧��֮һ��
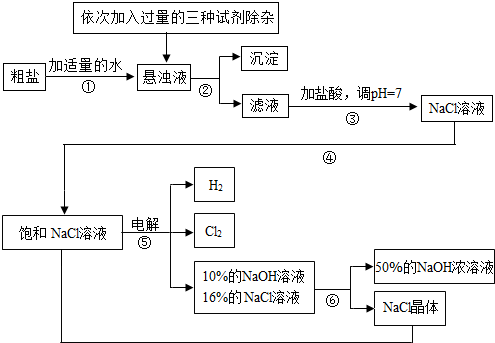
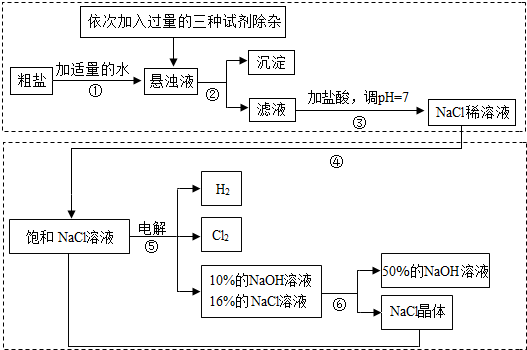
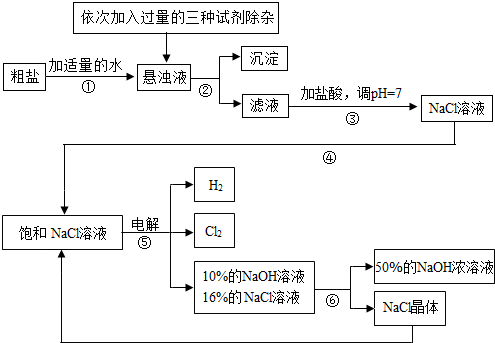
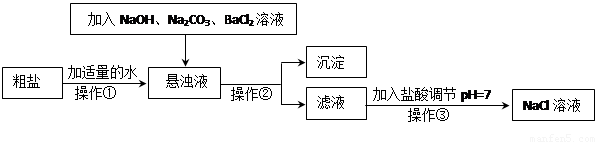
��.���ڴ����к�������MgCl2��CaCl2��Na2SO4�����ʣ������ϵ��Ҫ����˱��뾭�����ơ���ͼ�Ǵ��ξ��Ƶ����̣�
 �ش��������⣺
�ش��������⣺
��1�������ڵ������� ��
��2��������Һ�м�NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����Լ���˳�������Ϊ ��
A���ȼ���NaOH�������Na2CO3���ټ���BaCl2��Һ
B���ȼ���NaOH�������BaCl2��Һ���ټ���Na2CO3
C���ȼ���BaCl2��Һ�������NaOH���ټ���Na2CO3
D���ȼ���BaCl2��Һ�������Na2CO3���ټ���NaOH
��ͬѧ����� ��Һ����BaCl2��Һ�ɴﵽͬ����Ŀ�ġ�
��.��ͼ�ǵ��ʳ��ˮ��ȡ�������������ƵȲ�Ʒ�����̣�
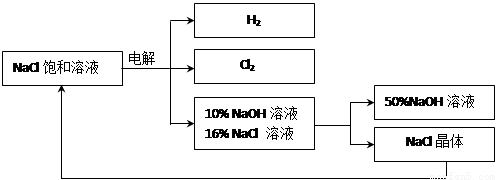
��3���ڵ������У������ķ�ӦΪ2NaCl + 2H2O Cl2 ��+ H2 �� + 2NaOH��������Һ��pH
��������ߡ��������䡱�������͡���
Cl2 ��+ H2 �� + 2NaOH��������Һ��pH
��������ߡ��������䡱�������͡���
��4�� ���ʳ��ˮʱ�����ֹCl2��NaOH��Ӧ����Cl2��NaOH��Һ��ֽӴ�������NaClO���Ȼ��ơ�ˮ����д��Cl2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
��5���������п���ѭ�����õ������� ��
��6����ȡ100g��������������Ϊ25%���Ȼ�����Һ���е�⣬һ��ʱ���ֹͣͨ�磬��������������7.1g������㣺��������������Ϊ���ٿˣ���Ӧ����Һ��NaOH�����������Ƕ��٣���д��������̣���������ȷ��0.1%��
��7����ʹ��6���е������Һ�ָ���ԭ��״̬����������Һ�м��������� ��
��.��1�����ˣ�1�֣� ��2�� BCD ��1�֣����2����0.5�֣����3����1�֡���Ba(OH)2 ��1�֣�
��.��3�����ߣ�1�֣� ��4�� 2NaOH + Cl2 === NaClO+NaCl + H2O ��1�֣�
��5�� NaCl��1�֣�
��6����: �裺��������������Ϊx,�������Ƶ�����Ϊy
2NaCl + 2H2O Cl2 ��+ H2 ��+ 2NaOH
Cl2 ��+ H2 ��+ 2NaOH
117 ���� 71 2 80
7.1g x y
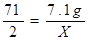 X=0.2 g ( 1�� )
X=0.2 g ( 1�� )
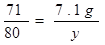 y =8 g ( 1�� )
y =8 g ( 1�� )
��Ӧ��������Һ��������������: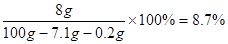 ( 1�� )
( 1�� )
��7�� HCl���Ȼ��� (1��)
����������. ������Һ�м�NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����Լ���˳��Na2CO3+BaCl2=2NaCl+BaCO3�����ȼ�BaCl2��Һ��������Na2CO3��Һ���������ϡ������ڵ���Һ�����ԣ�Na2CO3+2HCl=2NaCl+H2O+CO2��; �����ȼ���Na2CO3��Һ��������BaCl2��Һ������ȥ�����������Լ����С�����˳��һ��ҪʹBaCl2��Һ��Na2CO3��Һ֮ǰ���룬��B��C��D���߶���ȷ������Ba(OH)2��Һ���BaCl2��Һ������ΪNa2CO3+BaCl2=2NaOH+BaCO3����NaOH+HCl=NaCl+H2O�����������µ����ʡ�
��. 2NaCl + 2H2O Cl2
��+ H2 ��+ 2NaOH����Ӧ����NaOH����������ǿ������Խǿ��PHֵ��Խ��PH���ߡ�
Cl2
��+ H2 ��+ 2NaOH����Ӧ����NaOH����������ǿ������Խǿ��PHֵ��Խ��PH���ߡ�