题目内容
【题目】安多夫是一种嫩肉粉,成分是碳酸氢钠和氯化钠。小明发现将拌了安多夫粉的猪肉放到锅中加入食醋等调料烧煮时会产生大量的气体,他对此颇感兴趣,决定对其进行探究。
【查阅资料】
(1)碳酸氢钠是白色细小晶体,加热到50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解。
(2)白色无水硫酸铜遇到水会变成蓝色。
【实验探究一】对烧煮时产生大量气体的探究
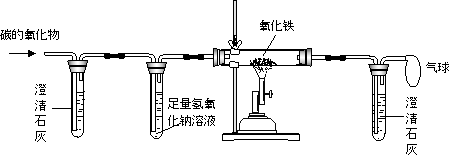
(1)小明对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2。他设法收集了除去醋酸气体的气体样品,用右图装置验证水蒸气和CO2存在。装置导气管口正确的连接顺序是为:
![]()

(2)小明对二氧化碳的来源作了两种猜测:
猜测①:二氧化碳可能是由 。
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的。
针对以上猜测,小明设计了以下实验:

【实验结论】:猜想①、②都正确
【实验探究二】测定安多夫样品中碳酸氢钠的含量
上述实验2中,小明发现充分反应后,试管中仍留有一些白色固体粉末,通过查阅资料发现是碳酸钠和氯化钠。小明想用测定白色固体中碳酸钠的质量来推算安多夫样品中碳酸氢钠的含量,于是称取实验2中得到的白色固体粉末6.9g,设计了如下实验方案:
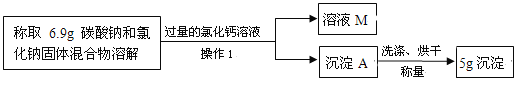
(1)“操作1”中玻璃棒的作用是 。
(2)实验中加入过量氯化钙溶液的目的是 。
(3)确定沉淀A已洗涤干净的方法是 。
(4)该安多夫样品中NaHCO3的质量分数是 。
【答案】【实验探究一】1.dcba或cdba(2分) 2.碳酸氢钠与食醋中的醋酸反应产生的
实验1取安多夫样品少许加入试管中,加入食醋,并把产生的气体通入澄清石灰水;有气泡产生,石灰水变浑浊
【实验探究二】(1)引流 (2)使碳酸钠完全反应 (3)取最后一次洗涤液,滴加硝酸银(或碳酸钠)溶液,无沉淀产生 (4)84%
【解析】
试题分析:用右图装置验证水蒸气和CO2存在。装置导气管口正确的连接顺序是为:气体样品dcba或cdba,过程中先检验水份的存在,再检验二氧化碳的存在,二者的顺序不能颠倒,因为验证二氧化碳的装置含有水份,二氧化碳的来源作了两种猜测: 猜测①:二氧化碳可能是由碳酸氢钠与食醋中的醋酸反应产生的。
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的;实验1取安多夫样品少许加入试管中,加入食醋,并把产生的气体通入澄清石灰水;有气泡产生,石灰水变浑浊,“操作1”中玻璃棒的作用是引流。实验中加入过量氯化钙溶液的目的是使碳酸钠完全反应。确定沉淀A已洗涤干净的方法是取最后一次洗涤液,滴加硝酸银(或碳酸钠)溶液,无沉淀产生;
设产生碳酸钙的质量需要碳酸钠的质量为X,需要碳酸氢钠的质量为Y
碳酸钠和碳酸钙及其碳酸氢钠之间的关系式为:
Na2CO3---CaCO3--- 2NaHCO3
106 100 168
X 5克 Y
列比例式解得 X=5.3克 Y=8.4克
药品中的氯化钠的质量=6.9克-5.3克=1.6克,
所以总质量为=8.4克+1.6克=10克。
所以碳酸氢钠的质量分数为=8.4克/10克×100%=84%。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案