题目内容
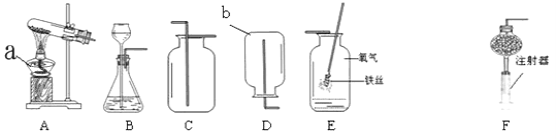
【题目】小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:
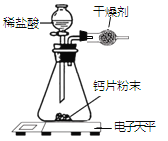
①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐 酸,置于电子天平上测出装置总质量。
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。
③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
反应前后质量差(克) | 0.66 |
容器内气体质量差(克) | m |
(1)该实验中,对装置中的固态干燥剂的性质有何要求? 。
(2)反应前容器内是空气(密度为ρ1),反应后全部是CO2(密度为ρ2)。则反应前后容器(容积为V)内的气体质量差m为 。(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数。(CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,钙片中的其它成分不与盐酸反应)
【答案】(1)能吸收水但不能吸收二氧化碳;(2)(ρ2--ρ1)V (3)50%
【解析】
试题分析:(1)固体干燥剂应该具有能吸收水但不能吸收二氧化碳的作用;(2)气体的质量为;等于密度与体积的乘积;故反应前后容器(容积为V)内的气体质量差m为(ρ2--ρ1)V(3)反应后质量的减小即为生成的二氧化碳的质量,其质量为:0.66g+0.22g=0.88g
设。碳酸钙的质量为x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
X 0.88g
100/44=x/0.88g
X=2g
该钙片中碳酸钙的质量分数为:2g/4g×100%=50%
答:该钙片中碳酸钙的质量分数为50%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目