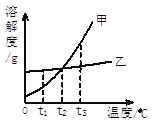题目内容
【题目】除去下列各物质中混有的少量杂质,所用试剂、方法有错误的是
序号 | 物质 | 杂质 | 试剂、方法 |
A | MnO2 | K2MnO4 | 加入足量水,充分溶解后过滤,洗涤干燥 |
B | MgCl2溶液 | 盐酸 | 加入过量的氢氧化镁,过滤 |
C | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
D | Cu | Fe | 用磁铁充分吸引 |
A. A B. B C. C D. D
【答案】C
【解析】A锰酸钾易溶于水,二氧化锰不溶,加足量水溶解过滤,滤渣中只有二氧化锰;B,盐酸和过量的氢氧化镁反应生成氯化镁和水,过滤后溶液中溶质只有氯化镁;C氧化钙和碳酸钙都能与盐酸反应生成氯化钙;D铁能被磁铁吸引,铜不能;选C

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】已知氧化铜还原成铜的过程中有氧化亚铜生成。如图是小华同学用CO还原氧化铜的实验装置图,当玻璃管中黑色物质全部变红后,小华想知道红色物质中有哪些成分?请你与小华一起完成下面的探究。
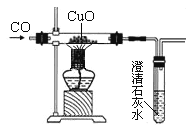
【提出猜想】①全部是铜; ②全部是氧化亚铜;③是铜和氧化亚铜的混合物。
【查阅资料】氧化亚铜是一种红色固体,能与稀硫酸发生如下反应:
Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验】为了验证这些猜想,小华同学进行了以下探究活动,请完成下列问题:
步骤 | 现象或数据 | 结论 |
(1)称取14.4g反应生成的红色固体于试管中,向其中加入足量的稀硫酸; | 现象:_______; | 猜想①错误 |
(2)将步骤(1)反应后的物质进行过滤,称量干燥后的固体质量为m。 | 数据: 若m = 6.4g; | ________ |
数据:若m_______6.4g (填:>、<或=)。 | 猜想③正确 |
【交流反思】(1)小华实验装置中的石灰水的主要作用是______________________________,从环保角度看,该装置有待改进,请写出一种改进措施_____________________________。
(2)请写出氧化铜与CO反应生成氧化亚铜的化学方程式_________________________。
【题目】小华和小慧两位同学分别用如图所示的装置进行电解水实验。为了增强水的导电性,实验前小华向水中加入硫酸钠固体.则b试管中产生的气体是__(填化学式)。

小慧在做实验时误将氯化钠当成硫酸钠加入水中,结果在检验b气体时闻到一股刺激性气味.在老师的指导下小华和小慧一起就这一异常现象开展了研究.
【定性研究】
(1)小慧猜想刺激性气味气体是氯化氢或氨气.小华则认为一定不是氨气,理由是______.
在老师指导下得知:①食盐水通电时发生反应:2NaCl+2H2O═2NaOH+H2↑+Cl2↑;
②氯气是一种有刺激性气味的有毒气体.由此可推测该刺激性气味的气体是____。
(2)定剩余溶液中的溶质,小慧进行如下实验,请帮她将实验报告补充完整.
实验操作 | 实验现象 | 实验结论 |
①取少量剩余溶液,滴入氯化铜溶液. | 产生蓝色絮状沉淀 | 溶液中含有_____ |
②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液 | _____ | 溶液中含有氯化钠 |
小华则认为实验②不能确定一定有氯化钠,理由是______。
【定量研究】
两位同学按如图所示的实验步骤进行实验:
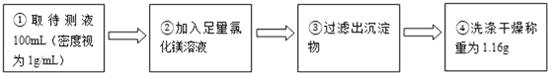
(1)步骤②加入的氯化镁溶液必需足量,其目的是______________。滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,______________(写出实验步骤、现象和结论).
(2)计算待测液中氢氧化钠的质量分数(写出计算过程)_____
【实验反思】若步骤④中缺少洗涤干燥的操作,所测定氢氧化钠的质量分数将__(选填“偏大”、“偏小”或“没影响”).