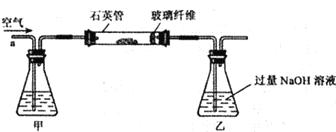
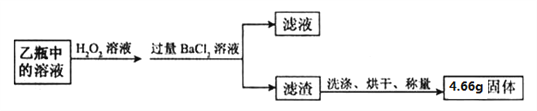
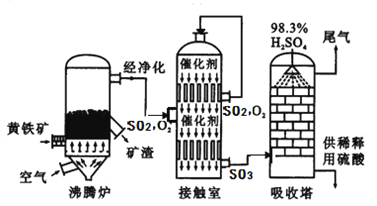
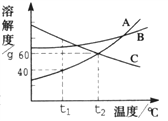
题目内容
【题目】根据表中的相关资料回答问题
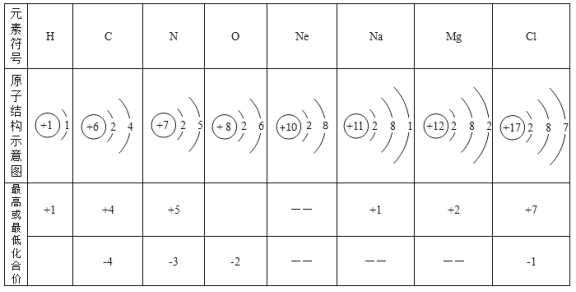
(1)上述元素中属于稀有气体元素的是______。
(2)根据表中的元素写出符合要求的化学式:
①可能引起温室效应的气体_______。
②Cl、O组成的自来水消毒剂(Cl显+4价)____。
③能使紫色石蕊试液变蓝的气体________。
④“西气东输”所输气体______。
⑤显碱性的盐______。
(3)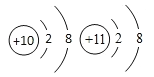 两者关系是_________(填字母)。
两者关系是_________(填字母)。
A.同种元素 B.不同种元素
【答案】 Ne CO2 ClO2 NH3 CH4 Na2CO3 B
【解析】根据所学知识和题中信息知,(1)上述元素中属于稀有气体元素的是Ne。(2)①可能引起温室效应的气体是CO2 。②Cl、O组成的自来水消毒剂(Cl显+4价)是ClO2 。③能使紫色石蕊试液变蓝的气体是 NH3 。④“西气东输”所输气体是CH4 。⑤显碱性的盐是Na2CO3 。⑶两者关系是B.不同种元素,核内质子数不同。
点睛∶本题主要考查化学式。

练习册系列答案
相关题目
【题目】除去下列各物质中混有的少量杂质,所用试剂、方法有错误的是
序号 | 物质 | 杂质 | 试剂、方法 |
A | MnO2 | K2MnO4 | 加入足量水,充分溶解后过滤,洗涤干燥 |
B | MgCl2溶液 | 盐酸 | 加入过量的氢氧化镁,过滤 |
C | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
D | Cu | Fe | 用磁铁充分吸引 |
A. A B. B C. C D. D