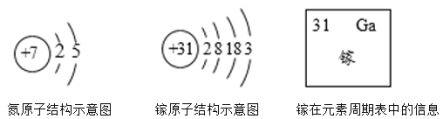
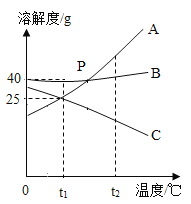
题目内容
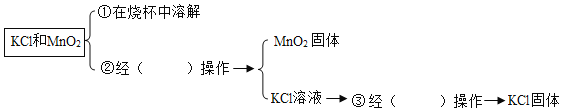
【题目】工业采用电解氯化钠溶液制备烧碱。某同学取电解后的溶液进行如下探究:
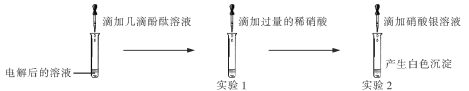
(提出问题)电解后的溶液中的溶质是什么?
(猜想假设)(1) NaOH、NaCl (2) NaOH
(实验探究)取电解后的溶液,进行如下实验:
(收集证据)实验1的反应现象为(1)____________,实验2发生反应的化学方程式为(2)_______。
(实验结论)电解后的溶液中的溶质是(3)____________________。
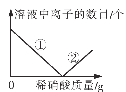
(表达交流)实验中滴加酚酞溶液的作用是(4)____________________。在滴加过量稀硝酸的过程中,下图中①表示的是(5)____________________(填符号),②表示的是(6)____________________(填符号)。
(总结规律)通过探究还可以认识到:上述实验1和实验2的反应都是两种化合物在溶液中以(7)____________________的形式,通过一种(8)____________________的方式而发生的复分解反应。
【答案】溶液由红色变为无色 ![]() NaOH和NaCl 为了证明电解后的溶液中含有氢氧化钠 OH- H+ 离子 相互交换成分
NaOH和NaCl 为了证明电解后的溶液中含有氢氧化钠 OH- H+ 离子 相互交换成分
【解析】
[收集证据]
(1)电解氯化钠溶液会生成氢氧化钠,氢氧化钠是一种碱,酚酞溶液遇碱性溶液会变红,加入过量稀硝酸会反应掉氢氧化钠,最终溶液显酸性,酚酞遇酸不变色,故实验1的反应现象为:溶液由红色变为无色;
(2)实验2中滴加硝酸银溶液产生白色沉淀,发生的反应是氯化钠和硝酸银反应,生成白色氯化银沉淀和硝酸钠,化学方程式为:![]() ;
;
[实验结论]
(3)由实验1和实验2中的现象可知,电解后的溶液中含有氢氧化钠和氯化钠,即电解后的溶液中的溶质是:NaOH和NaCl;
[表达交流]
(4)为了证明电解后的溶液中含有氢氧化钠,滴加酚酞溶液后变红,加入足量硝酸后红色逐渐消失,进而证明了氢氧化钠的存在,故实验中滴加酚酞溶液的作用是:为了证明电解后的溶液中含有氢氧化钠;
(5)电解后的溶液中含有氢氧化钠,在滴加稀硝酸的过程中发生反应,![]() ,氢氧根离子数目逐渐减少直至为0,当氢氧化钠反应完全后,继续滴加硝酸,氢离子数目逐渐增加,故①表示的是OH-,②表示的是H+;
,氢氧根离子数目逐渐减少直至为0,当氢氧化钠反应完全后,继续滴加硝酸,氢离子数目逐渐增加,故①表示的是OH-,②表示的是H+;
(6)由(5)的分析可知,②表示的是H+;
[总结规律]
实验1中氢氧化钠在溶液中以Na+和OH-的形式存在,加入硝酸会解离出H+和NO3-,OH-和H+结合生成H2O;实验2中氯化钠解离出Na+和Cl-,加入的硝酸银解离出Ag+和NO3-,Cl-和Ag+结合生成白色AgCl沉淀,即述实验1和实验2的反应都是两种化合物在溶液中以离子的形式,通过一种相互交换成分的方式而发生的复分解反应,故答案为:(7)离子,(8)相互交换成分。