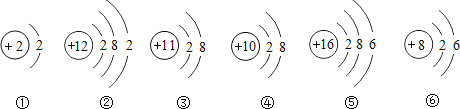
题目内容
【题目】电解法是工业上制铜的主要方法,控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO4+2H2O![]() 2Cu↓+O2↑+2H2SO4。取一定质量的硫酸铜溶液,在实验室中,模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6克铜(注:本题不考虑气体在溶液中的溶解)。回答下列问题,
2Cu↓+O2↑+2H2SO4。取一定质量的硫酸铜溶液,在实验室中,模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6克铜(注:本题不考虑气体在溶液中的溶解)。回答下列问题,
(1)原硫酸铜溶液中溶质的质量分数是多少_______?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某物质,充分反应后,所得溶液的质量,溶质质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的_________(填选项编号)。
A Cu B CuO C Cu(OH)2 D CuCO3
【答案】4.8% BD
【解析】
(1)设原有硫酸铜的质量为x,反应生成氧气的质量为y。

![]()
x=24g
y=2.4g
原硫酸铜溶液为:488.0g+9.6g+2.4g=500g
原硫酸铜溶液中溶质的质量分数为:![]() ×100%=4.8%
×100%=4.8%
(2)A、Cu不与盐酸反应,错误;
B、![]()
C、![]()
D、![]()
故选BD。

练习册系列答案
相关题目