题目内容
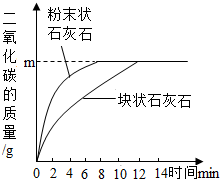 有一种石灰石样品的成分是碳酸钙和二氧化硅(SiO2是一种不溶于水,不与盐酸反应,耐高温的固体),某化学兴趣小组为测定这种石灰石样品中二氧化硅的质量分数,进行了如下实验:
有一种石灰石样品的成分是碳酸钙和二氧化硅(SiO2是一种不溶于水,不与盐酸反应,耐高温的固体),某化学兴趣小组为测定这种石灰石样品中二氧化硅的质量分数,进行了如下实验:①称取25.0g石灰石样品,平均分成质量相等的两份,并分别加工成块状和粉末状;
②将100mL稀盐酸平均分成体积相等的两份,并分别倒入两个锥形瓶中;
③将上述两份样品分别投入各盛有50mL稀盐酸(足量)的两个锥形瓶中,测得生成二氧化碳的质量与反应时间的关系如右图所示.请回答:
(1)由图中曲线分析得出,影响该化学反应速率的因素是:
反应物间的接触面积
反应物间的接触面积
.(2)若实验测得该石灰石样品中二氧化硅的质量分数为20%,则m的值为多少?(要有计算过程)
(3)若再称取12.5g二氧化硅的质量分数为20%的该石灰石样品进行煅烧,一段时间后冷却至室温,称得剩余固体的质量
为10.3g,则10.3g剩余固体中钙元素的质量为
4g
4g
.分析:(1)根据关系图中粉末状石灰石与块状石灰石完全反应所消耗时间的关系,推断影响该化学反应速率的因素;
(2)依据二氧化硅的质量分数可以求出碳酸钙的质量,而后利用方程式计算出生成的二氧化碳质量即可;
(3)依据化学反应前后元素的质量不变分析解答;
(2)依据二氧化硅的质量分数可以求出碳酸钙的质量,而后利用方程式计算出生成的二氧化碳质量即可;
(3)依据化学反应前后元素的质量不变分析解答;
解答:解:(1)观察关系曲线,可知相等质量的粉末状石灰石反应的速率比块状石灰石的反应速率大,可判断是由于粉末状石灰石与稀盐酸接触更充分,从而可知反应物间的接触面积影响反应的速度;(2)设12.5g的石灰石样品可生成CO2质量为m
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g×(1-20%) m
=
m=4.4g
(3)依据质量守恒定律可知反应的前后钙元素的质量不变,则有12.5g×(1-20%)×
×100%=4g;
故答案为:(1)反应物间的接触面积;(2)答:m的值为4.4.(3)4g;
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g×(1-20%) m
| 100 |
| 44 |
| 5g×(1-20%) |
| m |
m=4.4g
(3)依据质量守恒定律可知反应的前后钙元素的质量不变,则有12.5g×(1-20%)×
| 40 |
| 100 |
故答案为:(1)反应物间的接触面积;(2)答:m的值为4.4.(3)4g;
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
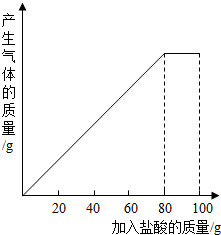 有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:
有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(2)石灰石样品中CaCO3质量分数为多少?(结果精确到0.1%)
(3)10%的CaCl2溶液可作为路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰右粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
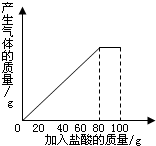 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?(结果用最简整数比表示)
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据;
欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,请计算:这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | 25 | 20 | 15 | 15 |
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不溶于水也不与盐酸反应),得到如下表部分数据.
请计算:
(1)第2次加入盐酸后,a为 g.
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 | 15 | 15 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
