题目内容
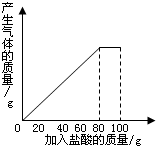 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?(结果用最简整数比表示)
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
分析:(1)由图表分析,三次参加反应的物质质量相等,由此计算出第二次参加反应的物质质量,再由剩余固体的质量=总质量-参加反应的物质质量可计算出a的值;
(2)根据题意和图表分析,可得到样品中CaCO3的质量,再根据CaCO3中钙元素、碳元素和氧元素的质量计算出它们各占的比值;
(3)由化学方程式可以计算出与100g稀盐酸反应的碳酸钙的质量、同时又能计算出生成的氯化钙以及二氧化碳的质量;再根据质量守恒定律可以计算出反应后氯化钙溶液的质量;最后根据稀释前后溶质的质量不变即可计算需要向滤液中加入水的质量.
(2)根据题意和图表分析,可得到样品中CaCO3的质量,再根据CaCO3中钙元素、碳元素和氧元素的质量计算出它们各占的比值;
(3)由化学方程式可以计算出与100g稀盐酸反应的碳酸钙的质量、同时又能计算出生成的氯化钙以及二氧化碳的质量;再根据质量守恒定律可以计算出反应后氯化钙溶液的质量;最后根据稀释前后溶质的质量不变即可计算需要向滤液中加入水的质量.
解答:解:(1)由图象可知,第四次加入盐酸后,才得到完全反应,故在反应过程中,第一次充分反应后剩余固体的质量为30g,说明只有35g-30g=5g样品参与了反应,第三次充分反应后剩余固体的质量为20g,说明共有35g-20g=15g样品参与了反应,故第二次充分反应时,也只有5g样品参与了反应,故第2次加入盐酸后,a=35g-5g×2=25g;
故答案为25.
(2)根据图象分析,第4次加入盐酸后,样品中CaCO3完全反应.
样品中钙元素、碳元素和氧元素的质量比:
(20g×
):(20g×
):(20g×
+15g×
)=10:3:22
答:石灰石样品中钙元素、碳元素和氧元素的质量比为10:3:22.
(3)由图表可知,每消耗20g盐酸,消耗5gCaCO3,则100g盐酸消耗25gCaCO3.
设:100g盐酸完全反应后,溶液中CaCl2的质量为x,生成CO2的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
25g x y
=
,
=
;
解得:x=27.75g;y=11g;
所得CaCl2溶液的质量:25g+100g-11g=114g
设还需加入水的质量为z;
则
×100%=10%;
解得:z=163.5g;
答:还需向滤液中加水163.5g.
故答案为25.
(2)根据图象分析,第4次加入盐酸后,样品中CaCO3完全反应.
样品中钙元素、碳元素和氧元素的质量比:
(20g×
| 40 |
| 100 |
| 12 |
| 100 |
| 48 |
| 100 |
| 32 |
| 60 |
答:石灰石样品中钙元素、碳元素和氧元素的质量比为10:3:22.
(3)由图表可知,每消耗20g盐酸,消耗5gCaCO3,则100g盐酸消耗25gCaCO3.
设:100g盐酸完全反应后,溶液中CaCl2的质量为x,生成CO2的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
25g x y
| 100 |
| 25g |
| 111 |
| x |
| 100 |
| 25g |
| 44 |
| y |
解得:x=27.75g;y=11g;
所得CaCl2溶液的质量:25g+100g-11g=114g
设还需加入水的质量为z;
则
| 27.75g |
| 114g+z |
解得:z=163.5g;
答:还需向滤液中加水163.5g.
点评:本题要求学生了解完全反应和不完全反应的概念及特点,观察图表,分析数据,正确解答.在计算石灰石样品中钙元素、碳元素和氧元素的质量比为时,一定注意氧元素不只碳酸钙中有,二氧化硅中也有氧元素.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:
有一种石灰石样品的主要成分是CaCO3.课外小组同学将100g稀盐酸分5次加入到35g石灰石样品中(已知杂质不与盐酸反应也不溶于水),得到如下部分数据和图象.请仔细观察下列表格和图象计算:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(2)石灰石样品中CaCO3质量分数为多少?(结果精确到0.1%)
(3)10%的CaCl2溶液可作为路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰右粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据;
欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,请计算:这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | 25 | 20 | 15 | 15 |
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不溶于水也不与盐酸反应),得到如下表部分数据.
请计算:
(1)第2次加入盐酸后,a为 g.
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
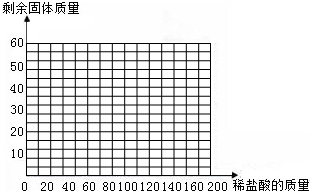
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 | 15 | 15 |
(1)第2次加入盐酸后,a为
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)10%的CaCl2溶液可作路面保湿剂.欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4)画出35g石灰石样品中加入盐酸的质量与剩余固体的质量变化关系的示意图(在“答题卡”框图中作图)
