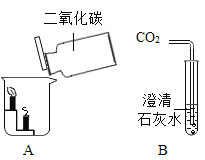
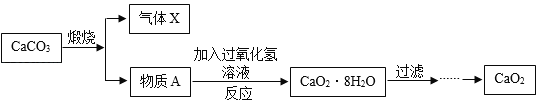
题目内容
【题目】小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图所示。从图中所获信息不正确的是
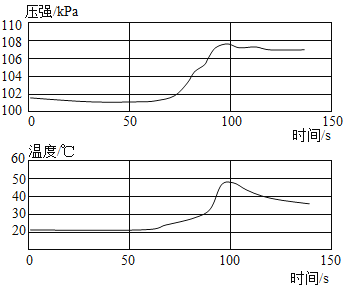
A.反应过程中有热量放出
B.50s时,溶液中溶质为AlCl3
C.0~50s,发生的反应主要为Al2O3+6HCl=2AlCl3+3H2O
D.100~140s,压强减小是因为温度降低
【答案】B
【解析】
A、由图可知,随着反应的进行,温度逐渐升高,说明反应过程中有热量放出,不符合题意;
B、将未打磨的铝片和稀盐酸放入密闭容器中,稀盐酸先与铝片表面的氧化铝反应生成氯化铝和水,待氧化铝完全反应后,稀盐酸再与铝反应生成氯化铝和氢气,从50s开始,压强逐渐增大,说明从这时开始,铝和稀盐酸开始反应生成氯化铝和氢气,故0~50s时,是氧化铝和稀盐酸反应生成氯化铝和水,50s时,稀盐酸未完全反应,溶液中溶质为AlCl3、HCl,符合题意;
C、0~50s时,是氧化铝和稀盐酸反应生成氯化铝和水,该反应的化学方程式为:![]() ,不符合题意;
,不符合题意;
D、一开始,氧化铝和稀盐酸反应生成氯化铝和水,压强变化不大,待氧化铝完全反应后,铝和稀盐酸反应生成氯化铝和氢气,有气体生成,且反应放热,压强逐渐增大,随后,反应结束,温度逐渐降低,压强减小,不符合题意。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】请回忆你和老师共同学习的酸和碱反应的实验探究,并按要求进行实验设计与
(实验探究)
(1)据图设计酸和碱反应:
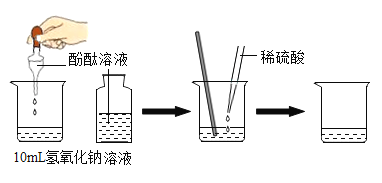
实验步骤 | 实验现象 | 结论 |
①向烧杯中加入 10mL 氢氧化钠溶液,并滴入几滴酚酞试液 | ①溶液颜色_____; | 酸和碱发生了中和反应。 |
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ②不断搅拌溶液至溶液颜色变成_____色 |
写出硫酸与氢氧化钠反应的化学方程式__________________。
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙两位同学设计了以下方案:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
甲同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
乙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
(实验评价)
①甲、乙两位同学设计的二个方案中,有一个正确的方案,是________(填“甲”“乙” )。
②请分析另一个同学方案错误的原因是__________。
(实验反思)
探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂是(__________)
AFe BCa(OH)2 CCuO DNa2CO3