题目内容
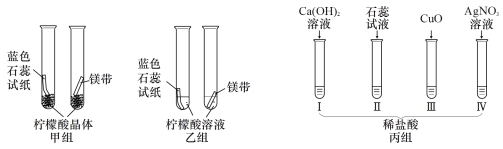
【题目】根据下列装置图,回答有关问题。


① 写出仪器名称:a (4) 。
② 用化学方程式表示实验室用石灰石和稀盐酸制取CO2的原理是 (5) 。取用块状石灰石的仪器是 (6) (填编号)。 上述可制CO2的实验装置是 (7) (填编号)。使用装置C的优点是 (8) 。
【答案】①锥形瓶 ②CaCO3+2HCl=CaCl2+ H2O+ CO2↑ Ⅲ A、B、C 随用随开,随关随停
【解析】
试题分析:①常见仪器的识记:锥形瓶
②实验室用石灰石和稀盐酸制取CO2的原理是:CaCO3+2HCl=CaCl2+ H2O+ CO2↑;取用块状石灰石的仪器应用镊子,故选Ⅲ;气体发生装置的选择依据:反应物的状态和反应条件,实验室制取二氧化碳属于固液常温型,故可制CO2的实验装置是:A、B、C;其中使用装置C的优点是:随用随开,随关随停

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行右图所示的实验,却未观察到预期现象。

【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
探究猜想② | 取4支试管,向其中分别加入 | 碳酸钠溶液浓度/% | 是否浑浊 |
10 | 不浑浊 | ||
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
【解释与结论】
(1)补全上述实验操作:取4支试管,向其中分别加入 。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 。
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是 。
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:

丙组同学的实验目的是 。
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是 。
【题目】一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。某小组为探究其成分进行如下实验:
Ⅰ. 取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示
Ⅱ. 取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红
Ⅲ. 向实验Ⅰ所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
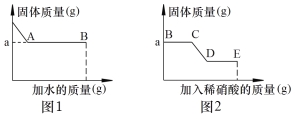
① CD段可观察到的现象是 (9) ,从D到E的溶液的pH (10) (填“增加”、“减小”、“不变”)。
② 根据上述实验得出原固体中一定有 (11) 。
③ 为进一步探究该白色固体成分,进行如下实验
步骤 | 现象 | 结论 |
取实验Ⅱ反应后的溶液于试管中, 加入 (12) | (13) | 原固体中有氢氧化钠 |
取实验Ⅱ反应后的溶液于试管中, 加入过量硝酸酸化,再加入硝酸银 | (14) | (15) |