题目内容
【题目】某KClO3和MnO2组成的混合物中钾元素的质量分数为30%,将13.0g该混合物加热至固体质量不再改变,下列有关说法错误的是
A. 加热后固体中钾元素的质量分数增加 B. 共生成3.2g氧气
C. 加热后,剩余固体的质量为8.2g D. 原混合物中MnO2的质量为0.75g
【答案】B
【解析】
A、加热时,氯酸钾在二氧化锰催化作用下,分解生成氯化钾和氧气,固体的质量不断减小,钾元素在化学反应过程中质量不变,固体中钾元素的质量分数增加,故A正确;B、13g混合物中钾元素的质量=13g×30%=3.9g,KClO3和MnO2组成的混合物中KClO3的质量=![]() ,设:12.25g的氯酸钾完全反应生成氧气的质量为x。
,设:12.25g的氯酸钾完全反应生成氧气的质量为x。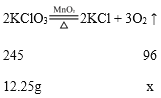
![]() x=4.8g。反应过程中共生成4.8g氧气,故B错误;C、根据B选项分析和质量守恒可知,加热后,剩余固体的质量=13g-4.8g= 8.2g,故C正确;D、根据B选项分析可知,原混合物中MnO2的质量=13 g-12.25g=0.75g,故D正确。故选B。
x=4.8g。反应过程中共生成4.8g氧气,故B错误;C、根据B选项分析和质量守恒可知,加热后,剩余固体的质量=13g-4.8g= 8.2g,故C正确;D、根据B选项分析可知,原混合物中MnO2的质量=13 g-12.25g=0.75g,故D正确。故选B。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】如图是化肥碳酸氢铵包装袋上的部分说明,可推测碳酸氢铵具有的性质有_______(填字母)。
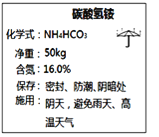
A.易溶于水 B.受热易分解
某同学提出疑问“这种化肥含氮量是否达到16%,化肥中碳酸氢铵的质量分数是多少?”
带着这些问题,该同学进入实验室完成了下列实验。
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3
②浓硫酸能吸收NH3但是不吸收CO2
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
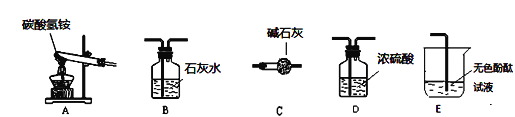
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是_____。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,观察到B中的现象是________。
③再取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是__________。
④碳酸氢铵在受热时发生反应的化学表达式是_______。
(含量分析)将装置A、C、D依次连接,加入10g化肥样品,加热至A中固体完全消失。称量装置D的质量如表 (各装置对气体吸收是完全的) :
实验前D装置的质量 | 150.0g |
实验后D装置的质量 | 151.7g |
⑤由此分析得知:反应中产生氨气的质量为__________g。
⑥通过反应的化学表达式可知:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥中氮元素的质量分数为__________(结果保留到0.1%)。
⑦此化肥中碳酸氢铵的质量分数为__________(结果保留到0.1%)。