题目内容
【题目】金属在生产生活中其中起着巨大的作用。
(1)铝可以用来制作炊具,这是利用了铝的___________性。
(2)相比于黄铁矿(主要成分FeS2),工业上选赤铁矿(主要成分Fe2O3)为原料炼铁的优点是______。
(3)小华同学利用如图实验探究金属的性质,请你一起完成。
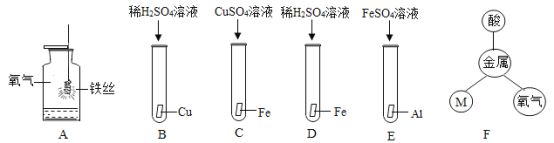
①图A中集气瓶内放入少量水的目的是___, D中除了出现铁片逐渐溶解,还出现的现象是______。
②图F中的物质M属____________(填物质类别);
③如果只用一种溶液就能比较铝、铁、铜的金属活动性强弱,则这种试剂是_______。
(4)为测定某镁铜合金(假定不含其它杂质)中镁的质量分数,小李取一块质量为10克的镁铜合金,放入烧杯中,向其中加入足量的稀盐酸完全反应,反应后过滤,向滤液中加入过量的氢氧化钠溶液,反应后过滤得沉淀,经洗涤、干燥后称量质量为8.7克,则该合金中镁的质量分数为多少_______? (写出计算过程)
【答案】导热 赤铁矿含铁量高且污染小 防止熔融物炸裂集气瓶底 产生气泡且溶液呈浅绿色 盐 硫酸亚铁溶液 36%
【解析】
(1)铝具有导热性,所以可用来制炊具;故填:导热。
(2)赤铁矿的主要成分是Fe2O3,矿石中含铁元素,冶炼时产生的大气污染物相对较少,含铁量比较高;黄铁矿的主要成分是FeS2,冶炼时会产生大量的二氧化硫,造成空气污染和酸雨;故填:赤铁矿含铁量高且污染小。
(3)①铁丝在燃烧过程中会放出大量的热,且生成物的温度较高,因此集气瓶内放入少量水的目的是防止熔融物炸裂集气瓶底;铁和稀硫酸反应生成硫酸亚铁和氢气,因此D中除了出现铁片逐渐溶液,还出现的现象是产生气泡和溶液变为浅绿色。故填:防止熔融物炸裂集气瓶底;产生气泡且溶液呈浅绿色。
②金属能和氧气、酸、盐发生反应,而图中已有氧气和,故图F中的物质M属于盐。故填:盐。
③只用一种溶液就能比较铝、铁、铜的金属活动性强弱,可以利用稀盐酸或稀硫酸与金属反应产生的气泡速率来进行比较,铝产生气泡的速率较快,铁产生的气泡速率较慢,铜不产生气泡,因此能比较出它们的活动性。故填:稀硫酸(或稀盐酸或者硫酸亚铁溶液)。
(4)设合金中镁的质量分数为x。
由题意可知,镁铜合金中的镁与稀盐酸反应生成了氯化镁,氯化镁又与氢氧化钠反应生成了氢氧化镁沉淀,即合金中的镁最终全部转化中氢氧化镁沉淀,因此镁与氢氧化镁的质量关系是:

![]()
x=36%
答:该合金中镁的质量分数为36%。