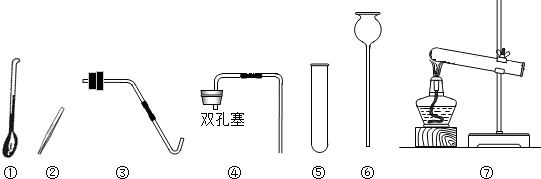
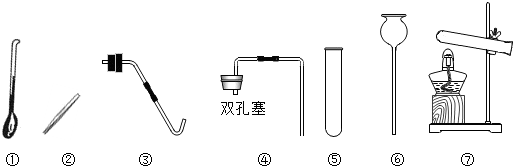
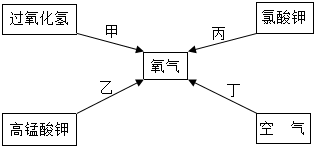
题目内容
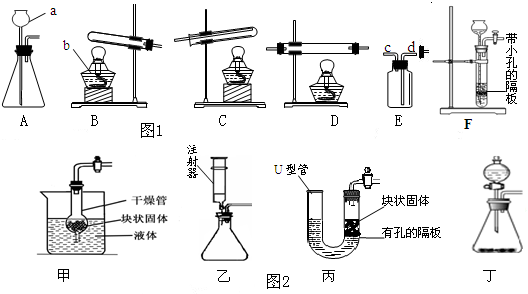
现有如图甲下列仪器或装置,请回答下列问题:
(1)仪器①的名称是 ;
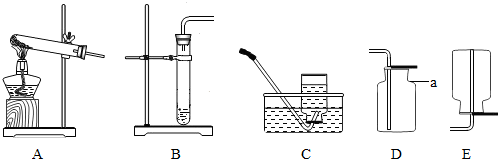
(2)请用如图仪器按以下要求组装成制气装置,并写出产生气体的反应化学方程式:
①用高锰酸钾加热制O2应选 (填字母), ;
②实验室制取CO2应选 (填字母), ;
③用废铁屑与稀盐酸反应制取H2,应选 (填字母), ;
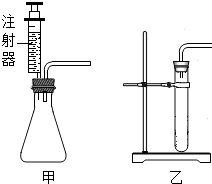
(3)若用F装置进行CO还原Fe2O3的实验,b处的现象为 ;要检验反应后的气体中含有CO2,仪器②中应装的试剂名称为 .该装置的不足之处是 ;王佳同学认为“该实验虽然完毕为了防止液体倒吸,但也没有必要将试管和玻璃管先分离开”,请你说出他这一观点的理由 .
(4)若用如图乙装置进行“排空气法”收集制取的H2,请把图中的“导气管”补画完整.
(5)我国铁矿石资源比较丰富,2000年钢铁年总产量就已达到1.27亿吨,成为世界钢铁大国.某钢铁厂日产含3%杂质的生铁2240t,则需要含Fe2O3 80%的赤铁矿多少吨?

(1)仪器①的名称是
(2)请用如图仪器按以下要求组装成制气装置,并写出产生气体的反应化学方程式:
①用高锰酸钾加热制O2应选
②实验室制取CO2应选
③用废铁屑与稀盐酸反应制取H2,应选
(3)若用F装置进行CO还原Fe2O3的实验,b处的现象为
(4)若用如图乙装置进行“排空气法”收集制取的H2,请把图中的“导气管”补画完整.
(5)我国铁矿石资源比较丰富,2000年钢铁年总产量就已达到1.27亿吨,成为世界钢铁大国.某钢铁厂日产含3%杂质的生铁2240t,则需要含Fe2O3 80%的赤铁矿多少吨?
分析:(1)据常用仪器回答;
(2)据反应物状态和反应条件选择发生装置,据反应原理书写方程式;
(3)一氧化碳具有还原性,可与红色的氧化铁反应生成黑色的铁粉和二氧化碳,检验二氧化碳用澄清石灰水;一氧化碳有毒,所以要据其性质进行尾气处理;并根据一氧化碳还原氧化铁的实验步骤分析解答;
(4)氢气的密度比空气小,所以应从短管进气,将空气挤压到集气瓶底部排出;
(5)纯物质的质量=不纯物质的质量×纯物质的质量分数,据此可知生铁中铁的质量,然后结合方程式计算出需要赤铁矿石的质量.
(2)据反应物状态和反应条件选择发生装置,据反应原理书写方程式;
(3)一氧化碳具有还原性,可与红色的氧化铁反应生成黑色的铁粉和二氧化碳,检验二氧化碳用澄清石灰水;一氧化碳有毒,所以要据其性质进行尾气处理;并根据一氧化碳还原氧化铁的实验步骤分析解答;
(4)氢气的密度比空气小,所以应从短管进气,将空气挤压到集气瓶底部排出;
(5)纯物质的质量=不纯物质的质量×纯物质的质量分数,据此可知生铁中铁的质量,然后结合方程式计算出需要赤铁矿石的质量.
解答:解:(1)编号仪器是铁架台;
(2)①用高锰酸钾加热制O2需要加热,属于固体加热型,故选发生装置D,并需要用到带导管的单孔塞B,加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4
K2MnO4+MnO2+O2↑;
②实验室制取二氧化碳用大理石和稀盐酸反应,不需要加热,故选发生装置E,同时需要添加液体的长颈漏斗,该反应生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③用废铁屑与稀盐酸反应制取H2,不需加热,故选发生装置E,同时需要添加液体的长颈漏斗,该反应生成氯化亚铁和氢气,方程式是:Fe+2HCl=FeCl2+H2↑;
(3)一氧化碳具有还原性,可与红色的氧化铁反应生成黑色的铁粉和二氧化碳,要检验反应后的气体中含有CO2,仪器②中应装澄清石灰水,观察石灰水是否变浑浊;该实验的步骤为‘先通一氧化碳排尽试管内空气,然后点燃酒精灯加热,待红色粉末变黑停止加热,继续通一氧化碳至试管冷却,防止生成的铁重新被氧化’,由实验步骤可知:有部分一氧化碳未参加反应排出,由于一氧化碳有毒,为了防止其污染大气,可据其可燃性进行尾气处理,而图示中未进行处理,这是该装置的不足之处;由步骤可知:停止加热后还要继续通CO至玻璃管冷却为止,所以即使不将试管和玻璃分离开,试管内液体也不会倒流;
(4)氢气的密度比空气小,所以应从短管进气,将空气挤压到集气瓶底部排出,图如下;
(5)设需要含Fe2O3 80%的赤铁矿质量为x,
Fe2O3+3CO
2Fe+3CO2
160 112
x×80% 2240 t×(1-3%)
=
x=
=3880t
故答案为:(1)铁架台;
(2)①BD;2KMnO4
K2MnO4+MnO2+O2↑;
②C E;CaCO3+2HCl=CaCl2+H2O+CO2↑;
③C E;Fe+2HCl=FeCl2+H2↑;
(3)固体粉末由红色变为黑色; 澄清石灰水; c处缺少尾气处理装置;停止加热后还要继续通CO至玻璃管冷却为止,试管内液体不会倒流;
(4)
(5)答:需要含Fe2O3 80%的赤铁矿3 880 t.
(2)①用高锰酸钾加热制O2需要加热,属于固体加热型,故选发生装置D,并需要用到带导管的单孔塞B,加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4
| ||
②实验室制取二氧化碳用大理石和稀盐酸反应,不需要加热,故选发生装置E,同时需要添加液体的长颈漏斗,该反应生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③用废铁屑与稀盐酸反应制取H2,不需加热,故选发生装置E,同时需要添加液体的长颈漏斗,该反应生成氯化亚铁和氢气,方程式是:Fe+2HCl=FeCl2+H2↑;
(3)一氧化碳具有还原性,可与红色的氧化铁反应生成黑色的铁粉和二氧化碳,要检验反应后的气体中含有CO2,仪器②中应装澄清石灰水,观察石灰水是否变浑浊;该实验的步骤为‘先通一氧化碳排尽试管内空气,然后点燃酒精灯加热,待红色粉末变黑停止加热,继续通一氧化碳至试管冷却,防止生成的铁重新被氧化’,由实验步骤可知:有部分一氧化碳未参加反应排出,由于一氧化碳有毒,为了防止其污染大气,可据其可燃性进行尾气处理,而图示中未进行处理,这是该装置的不足之处;由步骤可知:停止加热后还要继续通CO至玻璃管冷却为止,所以即使不将试管和玻璃分离开,试管内液体也不会倒流;
(4)氢气的密度比空气小,所以应从短管进气,将空气挤压到集气瓶底部排出,图如下;
(5)设需要含Fe2O3 80%的赤铁矿质量为x,
Fe2O3+3CO
| ||
160 112
x×80% 2240 t×(1-3%)
| 160 |
| 112 |
| x×80% |
| 2240t×(1-3%) |
| 2240t×(1-3%) |
| 112×80% |
故答案为:(1)铁架台;
(2)①BD;2KMnO4
| ||
②C E;CaCO3+2HCl=CaCl2+H2O+CO2↑;
③C E;Fe+2HCl=FeCl2+H2↑;
(3)固体粉末由红色变为黑色; 澄清石灰水; c处缺少尾气处理装置;停止加热后还要继续通CO至玻璃管冷却为止,试管内液体不会倒流;
(4)

(5)答:需要含Fe2O3 80%的赤铁矿3 880 t.
点评:本题考查知识比较综合,既考查了气体的制取的反应原理、装置选取,又考查了不纯物的相关计算等,掌握相关知识才能结合题意灵活分析解答.

练习册系列答案
相关题目