题目内容
【题目】为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。

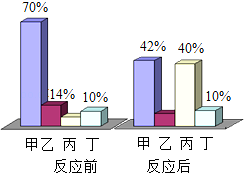
①A、D中酚酞均变_______色,说明两种溶液都呈碱性。
②B中溶液的pH______7(选填“>”、“<”或“=”)。写出氢氧化钠与盐酸反应的化学方程式:_________________。
③四支试管内的物质在G中混合后得到无色溶液(烧杯内无沉淀),其中一定含有的溶质是_______________。
【答案】红 < HCl+NaOH═NaCl+H2O 氯化钠、氯化钙、氯化钾
【解析】
①酚酞遇碱性溶液变红色。A、D中酚酞均变红色,说明两种溶液都呈碱性;
②由实验的过程可知,B溶液中有过量的盐酸,显酸性,溶液的pH<7;氢氧化钠与盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH═NaCl+H2O;
③由题意可知,四支试管内的物质在G中混合后得到无色溶液(烧杯内无沉淀),说明了溶液呈酸性或中性,不存在氢氧化钠、氢氧化钙和碳酸钾;混合时过量的盐酸能与氢氧化钠、碳酸钾、氢氧化钾、碳酸钙反应,所以反应的溶液中一定含有的溶质是:氯化钠、氯化钙、氯化钾,可能含有的溶质是氯化氢。

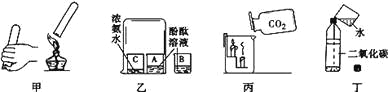
【题目】二氧化碳与我们生活息息相关,兴趣小组利用下图装置进行多角度探究。
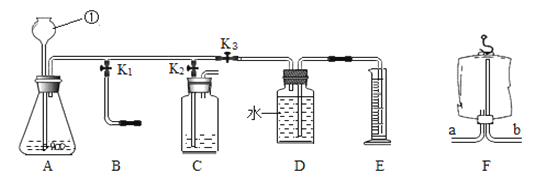
探究一 气体的制取
(1)写出图中①的仪器名称_________。
(2)用装置A制取二氧化碳的反应化学方程式是___________。
若装置A用于实验室制取氧气,则反应化学方程式是________。
(3)生活中有许多物品可以代替实验仪器,关闭K2和k3,打开K1,若用装置F所示的医用塑料袋排空气法收集CO2,则F装置_____(填“a”或“b”)端与B装置相连。
探究二 气体的性质检验
打开K2、关闭K1和K3,用于检验制取的二氧化碳性质。
(4)若装置C中试剂是澄清石灰水,则该反应的化学方程式是______。
探究三 测定气体生成的反应速率
关闭K1、K2,打开K3,可测一段时间内生成二氧化碳气体的速率。所测得数据如下:
稀盐酸的体积(mL)(反应前) | 大理石质量(g)(反应前) | E装置收集的液体量(mL) | 反应时间(S) |
50 | 5.0 | 37.8 | 100 |
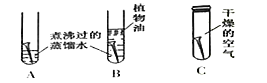
(5)实验时在D中加入一层植物油的目的是__________;若生成气体的反应速率用公式V=△V/△t表示(△V表示生成的气体的体积、△t表示反应所用的时间),由实验数据可知生成的二氧化碳的速率为_______________mL/S。