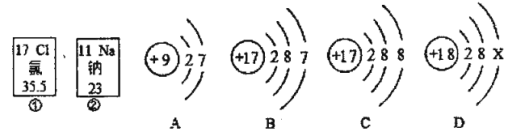
题目内容
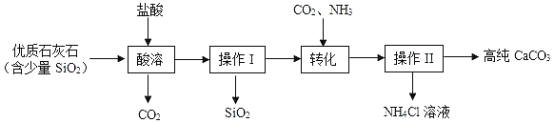
【题目】某化学兴趣小组同学为确定无色溶液X中的溶质,含碳酸钠、碳酸氢钠、氢氧化钠中的至少两种,开展了探究活动,请你一同参与。
(查阅资料)(1)CaCl2﹑NaCl溶液都呈中性,与NaHCO3溶液都不会反应
(2)NaHCO3溶液呈碱性,![]()
(3)NaOH与Ca(OH)2有相似的化学性质
(猜想与假设)猜想一:溶液X含有NaOH﹑Na2CO3
猜想二:溶液X含有Na2CO3﹑NaHCO3
猜想三:溶液X含有NaOH﹑NaHCO3﹑Na2CO3
针对猜想,有同学提出猜想三是错误的,其理由_______(用化学方程表示)。
(实验方案设计)
序号 | 实验步骤 | 预设实验现象 | 预设实验结论 |
① | 取样于烧杯中,滴入过量的氯化钙溶液,过滤, | _____ | 猜想一成立。 |
② | 取①的滤液于试管中,滴入适量的氢氧化钙溶液, | 无明显现象, | 猜想二__。 |
③ | 取①的滤液于试管中,滴入___溶液, | 溶液变红色 | 猜想_成立。 |
(结论与反思)由实验,得无色溶液X的溶质是NaOH﹑Na2CO3,经讨论后,有同学提出实验①的结论不完善,其理由是_____。
【答案】![]() 产生白色沉淀 不成立 无色酚酞 一 猜想二也有同样的现象
产生白色沉淀 不成立 无色酚酞 一 猜想二也有同样的现象
【解析】
[猜想与假设]碳酸氢根与氢氧根可以反应生成碳酸根和水,因此不能共存,所以碳酸氢钠与氢氧化钠反应生成碳酸钠和水,化学方程式为:NaHCO3+NaOH═Na2CO3+H2O;
[实验方案设计]①猜想一成立,说明含有碳酸钠,加入氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,因此可以看到白色沉淀;
②在①中加入足量的氯化钙,此时加入氢氧化钙后没有明显现象,说明没有碳酸氢钠存在,因此猜想二不成立;
③在①中加入足量氯化钙溶液后,氯化钙与碳酸钠反应生成了碳酸钙沉淀和氯化钠,此时存在的溶质有氯化钠和氯化钙,都显中性,加入酚酞变红,说明含有碱性物质,因此说明含有氢氧化钠,则推出猜想一成立;
[结论与反思]在①中加入氯化钙溶液,只能证明含有碳酸钠,所以猜想一和二都会发生相同实验现象,不能证明是否含有氢氧化钠或者碳酸氢钠。

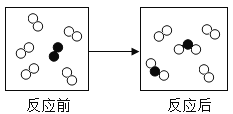
【题目】下列归纳总结完全正确的一组是( )
A.分子的特征 | B.数字“2”的含义 |
①水分子很小 ②固体物质的分子不运动 ③气体分子间的间隔很大 | ①Fe2+:1个亚铁离子带2个单位正电荷 ② ③NO2:1个二氧化氮分子中含有2个原子 |
C. 生活经验 | D.节约资源 |
①常用钢刷擦洗铝制品 ②食品包装中抽真空防腐 ③用汽油洗去衣服上的油污 | ①提倡使用太阳能 ②回收利用废旧金属 ③农业灌溉采用滴灌 |
A.AB.BC.CD.D