题目内容
【题目】人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
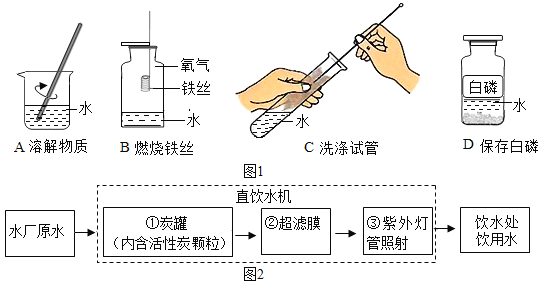
(1)下列金属制品中,利用金属导热的是___________(选填字母组号)
A金属硬币 B铝制导线 C铜制火锅
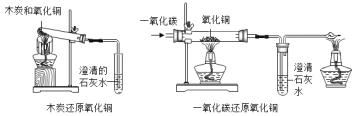
(2)我国古代就已经掌握了多种金属的冶炼技术,下面两幅图分别描述的是古人炼铁、炼铜的场景。

①图1中,古人将木炭与铁矿石堆入炉内,并鼓入空气,利用生成的CO将Fe2O3转化为铁单质。CO与Fe2O3反应的化学方程式为_______________ 。
②图1中,为了保护炉内高温,需要不断拉动风箱使木炭充分燃烧。不断拉动风箱可以使木炭充分燃烧的原因是__________________。
③图2中,古人将铁片放入富含硫酸铜的小溪中,获取铜单质,该反应的化学方程式为___________________ 。
(3)某汽修厂清洗汽车零件后的废液中含有一定量的AgNO3和Cu(NO3)2,向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤液中加入稀盐酸,没有白色沉淀产生。下列叙述正确的是____________________(选填字母序号)
A滤渣中一定没有Fe
B滤渣中一定有Fe(NO3)2和Cu(NO3)2
C滤渣中一定有Ag,可能有Cu
D滤渣中一定有Fe(NO3)2 ,一定没有AgNO3
【答案】C Fe2O3+3CO![]() 2Fe+3CO2 提供充足的氧气,使燃料燃烧充分 Fe+CuSO4═Cu+FeSO4 CD
2Fe+3CO2 提供充足的氧气,使燃料燃烧充分 Fe+CuSO4═Cu+FeSO4 CD
【解析】
解:(1)金属制硬币是利用了金属的耐腐性以及有金属光泽;铝制导线是利用了金属的导电性;铜制火锅是利用金属导热性;
(2)①一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,反应方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②不断拉动风箱可以使木炭充分燃烧原因是:提供充足的氧气,使燃料燃烧充分;
③铁和硫酸铜反应生成铜和硫酸亚铁,反应方程式是:Fe+CuSO4═Cu+FeSO4;
(3)由于金属的活动性是:铁>铜>银,向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,铁首先与硝酸银反应生成硝酸亚铁和银,当硝酸银反应完全后,铁再与硝酸铜反应生成硝酸亚铁和铜。充分反应后过滤,向滤液中加入稀盐酸,没有白色沉淀产生,说明了溶液中不存在硝酸银据此可知:
A.滤渣中是否有Fe无法判断,故A错误;
B.滤液中一定有Fe(NO3)2,Cu(NO3)2无法判断,B错误;
C、滤渣中一定有Ag,可能有Cu,故C正确;
D、滤液中一定有Fe(NO3)2,一定没有AgNO3,故D正确。

【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| 乙 | 丙 | |||
| 甲 | 丁 | 戊 |
(1)认识符号:NO3-名称是________;
(2)写化学式:丙物质的化学式是________;
(3)物质分类:五种物质中,属于碱的是________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是________(用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
无白色沉淀生成 | 溶液变红 | 溶液变为无色 | |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是________;步骤三中发生的任意一个化学反应的化学方程式是________。
(2)依据假设二的现象,原白色粉末可能的组成是________。(任写一种可能的组成,用化学式表示);
(3)依据假设三的现象,原白色粉末可能的组成有________种。