题目内容
【题目】如图是X、Y、Z三种固体物质的溶解度曲线,请回答下列问题:
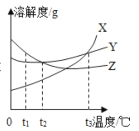
(1)t1℃时三种物质溶解度由大到小的顺序是_____。
(2)若将t2℃时X物质接近饱和的溶液转变成饱和溶液,可采用的方法是_____。(写一种)
(3)要配制溶质质量分数相同的Y、Z饱和溶液,需要把温度控制在_____℃。
(4)t2℃时,20g水中溶解10gX恰好形成饱和溶液中,则此时X的溶解度是_____g。
【答案】Z>Y>X 增加溶质 t2 50
【解析】
(1)通过分析溶解度曲线可知,t1℃时三种物质溶解度由大到小的顺序是:Z>Y>X;
(2)X物质的溶解度随温度的升高而增大,所以若将t2℃时X物质接近饱和的溶液转变成饱和溶液,可采用的方法是增加溶质;
(3)t2℃时,Y、Z物质的溶解度相等,所以要配制溶质质量分数相同的Y、Z饱和溶液,需要把温度控制在t2℃;
(4)t2℃时,20g水中溶解10gX恰好形成饱和溶液中,100g水中需要溶解50g的硝酸钾,所以此时X的溶解度是50g。

【题目】小强在帮老师整理实验室时,发现一瓶未密封的KOH固体,对其成分提出以下假设;并在老师的指导下进行试验探究。
(查阅资料):①KOH与NaOH的化学性质相似;请用化学方程式解释KOH变质的原因:_____.
②K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性;
(猜想与假设)通过分析,提出如下猜想:
假设Ⅰ:只含KOH; 假设Ⅱ:含KOH和K2CO3; 假设Ⅲ:只含K2CO3:
(实验探究)
实验操作步骤 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
②另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 | 有白色沉淀生成 | 假设Ⅲ正确 |
③取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论)步骤②中加入过量BaCl2溶液的作用是_____。
(拓展应用)完全变质的KOH也有利用价值,从K2CO3组成或性质看,其在农业上的用途是_____。