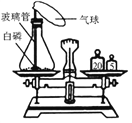
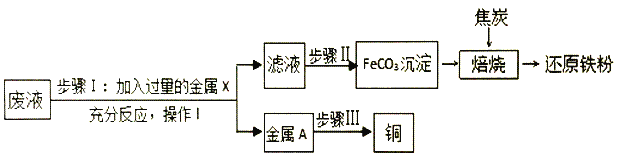
题目内容
【题目】写出下列化学方程式
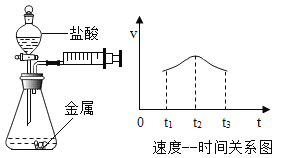
(1)铁与稀盐酸反应___________________________
(2)铁锈与稀硫酸反应__________________________
(3)电解水_________________________
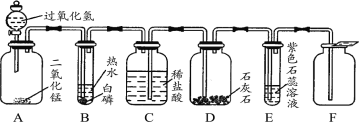
(4)实验室用过氧化氢制氧气 _____________________________
(5)用含氢氧化铝的药物治疗胃酸过多 _________________________
【答案】 Fe + 2HCl == FeCl2+H2↑ Fe2O3+ 3H2SO4= Fe2(SO4)3+ 3H2O 2H2O![]() 2H2↑+ O2↑ 2H2O2
2H2↑+ O2↑ 2H2O2![]() 2H2O+O2↑ 3HCl + Al(OH)3== AlCl3+ 3H2O
2H2O+O2↑ 3HCl + Al(OH)3== AlCl3+ 3H2O
【解析】本题考查了常见化学方程式的书写。
(1)铁与稀盐酸反应生成氯化亚铁和氢气,该反应化学方程式是Fe + 2HCl == FeCl2 +H2↑;
(2)铁锈与稀硫酸反应生成硫酸铁和水,该反应化学方程式是Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O;
(3)电解水生成氢气和氧气,该反应化学方程式是2H2O 通电 2H2↑+ O2 ↑;
(4)实验室用过氧化氢制氧气生成了水和氧气,该反应化学方程式是2H2O2 MnO2 2H2O+O2↑;
(5)氢氧化铝与盐酸反应生成氯化铝和水,该反应化学方程式是3HCl + Al(OH)3 == AlCl3。

 千里马走向假期期末仿真试卷寒假系列答案
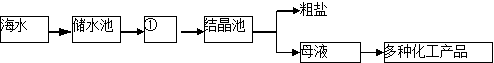
千里马走向假期期末仿真试卷寒假系列答案【题目】碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如下图所示。
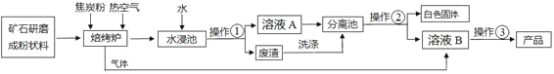
【已知】:碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应。但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度。
温度/℃ | 0 | 40 | 80 |
Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
(1)矿石研磨成粉末的目的_____________
(2)以下相关说法正确的是
A.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
B.焙烧炉内只涉及分解反应
C.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料
(3)写出焙烧炉中含钡元素物质发生反应的化学方程式: ;
(4)除了水之外,进入分离池中的物质是 和 ,请你推测分离池中操作②的方法是 (选填“A”或“B”)A.降温,过滤;B.加热,过滤
(5)写出由溶液B制取产品的化学方程式: ;
(6)若此矿石原料50t,得到的产品质量为19.7t,则此矿石中钡元素的质量分数__________(写出计算过程,共2分)