题目内容
【题目】将氯化钠和碳酸钠的混合物33.8g放入125g稀盐酸中恰好完全反应.得到氯化钠溶液150g. 试计算
(1)原混合物中碳酸钠的质量______.
(2)若将所得溶液稀释成质量分数为8%的溶液,需加水多少克______.
【答案】8.8g 300g
【解析】
(1)根据质量守恒定律可知二氧化碳的质量为:33.8g+125g-150g=8.8g。
生成8.8g的二氧化碳需要碳酸钠的质量为x;生成氯化钠的质量为y,
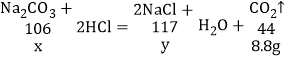
![]()
解得:x=21.2g y=23.4g
(2)由于溶液稀释前后溶质的质量不变,溶液中溶质的质量=23.4g+(33.8g-21.2g)=36g;则设需加水的质量是z,则得36g=(150g+z)×8%,z=300g
答:(1)原混合物中碳酸钠质量为21.2克;
(2)若将所得溶液稀释成质量分数为8%的溶液,需加水300克。

练习册系列答案
相关题目
【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?