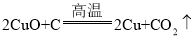题目内容
【题目】固体硝酸盐加热易分解且产物较复杂.以Mg(NO3)2为研究对象,四个学习小组拟通过实 验探究其热分解的产物,分别提出如下4 种猜想:
甲组:Mg(NO2)2、NO2、O2
乙组:MgO、NO2、O2
丙组:MgO、NO2、N2
丁组:Mg3N2、O2
查阅资料得知:
(1)在化学反应中,若有化合价升高,必然有元素化合价降低;
(2)NO2为红棕色气体且能被氢氧化钠溶液吸收;
(3)4NO2+ O2 + 4NaOH=4NaNO3+ 2H2O;
(4)Mg3N2能与水反应生成氢氧化镁和氨气;
(5)Na2SO3溶液呈弱碱性且Na2SO3易被O2氧化。
Ⅰ实验前,小组成员经讨论认定______组的猜想一定不成立,理由是______。 针对其他小组猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略)进行探究:
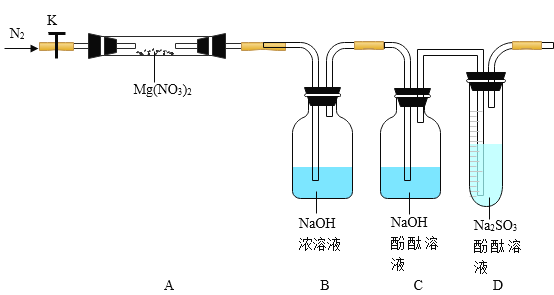
Ⅱ实验过程
①仪器连接后,在 D 中加水至浸没导管口,关闭 K,微热硬质玻璃管 A,观察到 D 中有气泡连续放出, 表明_____。
②硬质试管 A 的质量为 18.0g,装入固体后称得硬质玻璃管 A 与 Mg(NO3)2固体共 21.7g,加热前通入N2以驱尽装置内的空气,其目的是_____;关闭 K,用酒精灯加热时,正确操作是先_____然后固定在管中固体部位下加热。
③观察到 A 中有红棕色气体生成,C 中有气泡。
④待样品完全分解,A 装置冷却至室温、称量,测得硬质试管 A 和剩余固体的总质量为 19.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
Ⅲ实验结果分析讨论
①根据 D 中_____,证明分解产物中有O2,与此相关的化学原理为(用化学方程式表示)_____。根据实验现象和剩余固体的质量经分析可初步确认猜想______组结论是正确的。
②一位同学认为上述装置不能确认分解产物中有O2,他的理由你认为可能是_____。
据以上分析,Mg(NO3)2分解的化学方程式为_____。
【答案】丙 丙组中氮元素只降价,没有其他元素升价 装置气密性良好 排尽装置内原有空气,防止对氧气的检验造成干扰 预热 溶液褪色 ![]() 乙 D 装置与空气相连,空气中的氧气可能将 Na2SO3 氧化
乙 D 装置与空气相连,空气中的氧气可能将 Na2SO3 氧化 ![]()
【解析】
甲、乙、丙中都有氧气,避免空气中氧气干扰;根据加热试管的操作要求完成;氧气具有氧化性,可以将亚硫酸钠氧化成硫酸钠结合亚硫酸钠成碱性;D装置与空气相通,空气中的氧气可能将Na2SO3氧化,硝酸镁分解生成氧化镁、二氧化氮和氧气。
Ⅰ在化学反应中,若有化合价升高,必然有元素化合价降低,丙产物中化合价只有降低情况,没有升高,故实验前,小组成员经讨论认定丙组的猜想一定不成立,理由是丙组中氮元素只降价,没有其他元素升价。
Ⅱ实验过程
①仪器连接后,在 D 中加水至浸没导管口,关闭 K,微热硬质玻璃管 A,观察到 D 中有气泡连续放出, 表明装置气密性良好。
②甲乙丙猜想中产物都有氧气,没有氮气,用氮气排出装置中空气避免对产物氧气检验的干扰,加热前通入N2以驱尽装置内的空气,其目的是排尽装置内原有空气,防止对氧气的检验造成干扰;关闭 K,用酒精灯加热时,正确操作是先预热然后固定在管中固体部位下加热。
Ⅲ实验结果分析讨论
①氧气通过氢氧化钠不反应,而氧气通入亚硫酸钠时,则亚硫酸钠和氧气的反应生成硫酸钠,碱性溶液变成了中性,红色退去,故根据D中溶液褪色,证明分解产物中有O2,与此相关的化学原理是亚硫酸钠和氧气生成硫酸钠,故化学方程式表示为![]() 。根据实验现象和剩余固体的质量经分析可初步确认猜想乙组结论是正确的。
。根据实验现象和剩余固体的质量经分析可初步确认猜想乙组结论是正确的。
②D装置与空气相通,空气中的氧气可能将亚硫酸钠氧化,所以不能确认分解产物中有O2,应在D装置后再加一套除空气中的氧气装置,故他的理由可能是D 装置与空气相连,空气中的氧气可能将 Na2SO3 氧化。Mg (NO3)2分解生成氧化镁、二氧化氮和氧气,反应的化学方程式为![]() 。
。