题目内容
【题目】华为5G技术引领全球,华为手机生产过程中大量使用半导体材料——硅。元素周期表中硅元素的信息如下图所示,下列有关硅的说法正确的是
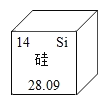
A.硅原子最外层电子数为14
B.硅是地壳中含量最多的元素
C.硅的相对原子质量为28.09g
D.硅元素与碳元素的化学性质相似
【答案】D
【解析】
A、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=原子的核外电子数=14,故硅原子的核外电子数是14,不是最外层电子数,不符合题意;
B、地壳中元素含量(由多到少):O、Si、Al、Fe、Ca,故含量最多的元素是氧元素,不符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,故硅的相对原子质量是28.09,相对原子质量是一个比值,单位为“1”,常省略不写,不符合题意;
D、硅元素的核外电子数是14,碳元素的核外电子数是6,最外层电子数都是4,化学性质相似,符合题意。
故选D。

练习册系列答案
相关题目