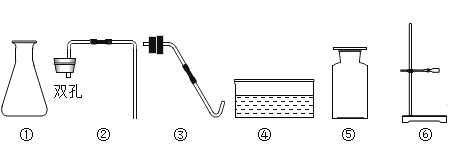
题目内容
【题目】生命的孕育和维系需要水和水溶液。
①自来水生产中加入氯气的作用是______________________。
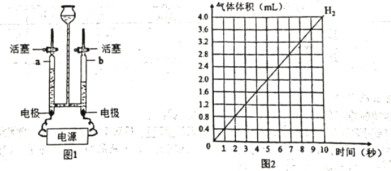
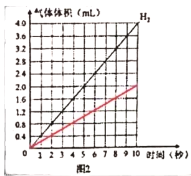
②图1实验中,____________ (选墳“a”或“b”) 处气体能使带火星的木条复燃,电解水的化学方程式为______________________。电解水过程中产生氢气的体积和反应时间的关系曲线如图2所示,请在图2中画出产生氧气的体积和反应时间的关系曲线__________(不考虑水中的溶解)。
③硝酸钾和氯化钠在不同温度下的溶解度见下表:
温度(°C) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度(g/100g水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
Ⅰ.20°C时 KNO3的溶解度是___________g/100g水,此温度下将15g KNO3固体加入50g水中充分搅拌,可以得到溶液的质量为_____________g。
Ⅱ.氯化钠中混有少量硝酸钾,提纯氯化钠的方法是_____________ (选填“降温结晶” 或“蒸发结晶”)。
Ⅲ.对50°C的等质量的硝酸钾和氯化钠饱和溶液分别降温至10°C,正确的说法是_____。
A 50°C时,溶液的浓度:硝酸钾>氯化钠
B 50°C时,溶剂的质量:硝酸钾>氯化钠
C 10°C时,溶液的质量:硝酸钾>氯化钠
D 10°C时,溶质的质量:硝酸钾<氯化钠
【答案】杀菌消毒 a 
 31.6 65 蒸发结晶 AD
31.6 65 蒸发结晶 AD
【解析】
①、氯气与水反应可以生成次氯酸,具有杀菌消毒的作用;
故答案为:杀菌消毒。
②、水通电生成氧气和氢气,两者气体体积比为1:2,所以a侧为氧气,可使带火星的木条复燃;水在通电条件下分解生成氧气和氢气,反应的化学方程式为 ;根据相同时间下,氧气体积为氢气的二分之一,绘制图像,如下所示
;根据相同时间下,氧气体积为氢气的二分之一,绘制图像,如下所示 ;
;
故答案为:a; ;
; 。
。
③、Ⅰ根据题目信息可知,20°C时 KNO3的溶解度是31.6g/100g水,由此可知50g水中最多可以溶解15.8g硝酸钾,而此时只有15g硝酸钾,所以可以全部溶解形成硝酸钾不饱和溶液,质量为15g+50g=65g;
故答案为:31.6;65。
Ⅱ根据题目信息可知,氯化钠溶解度随温度的升高而增大且变化不大,因此可以通过蒸发结晶的方法,制得氯化钠晶体;
故答案为:蒸发结晶。
ⅢA、根据题目信息,50℃饱和溶液时,硝酸钾溶解度大于氯化钠,而饱和溶液的溶质质量分数=![]() ,所以此时溶液浓度为硝酸钾大于氯化钠,选项A正确;
,所以此时溶液浓度为硝酸钾大于氯化钠,选项A正确;
B、50℃饱和溶液时,硝酸钾溶解度大于氯化钠,而溶液质量相等,说明硝酸钾溶液只需少于氯化钠溶液中溶剂质量,就可溶解溶质后,形成等质量的硝酸钾和氯化钠溶液,所以此时硝酸钾溶液中溶剂质量小于氯化钠溶液中溶剂质量,选项B错误;
C、根据题目信息,从50℃饱和溶液降温至10℃时,溶液仍为饱和溶液,而10℃时氯化钠溶解度大于硝酸钾,相应溶液质量为氯化钠大于硝酸钾,选项C错误;
D、硝酸钾溶解度随温度变化较大,氯化钠溶解度随温度变化较小,所以降温后,硝酸钾析出固体质量大于氯化钠固体质量,所以剩余溶液中,硝酸钾溶液中溶质质量小于氯化钠溶液中溶质质量,选项D正确;
故答案为:AD。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】某化学兴趣小组的同学在探究金属的有关性质时,进行了如图所示实验:在A实验结束后将两支试管内的物质倒入一洁净烧杯中,一段时间后过滤 。为确定过滤后得到的滤渣和滤液的成分,同学们进行了如下实验。
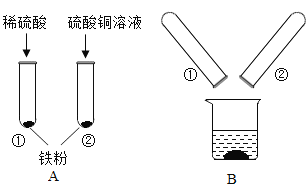
实验一:滤渣的成分是什么?
(1)甲同学取少量滤渣于试管中,加入稀硫酸,无气泡产生,证明滤渣里不含_________,乙同学通过物理方法也得到同样的结论,请简述其方法和现象:_________。
实验二:滤液里的溶质有哪些?
(2)同学们一致认为定有FeSO4,为确定可能含有其他溶质,同学们进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量滤液,向其中加入足量铝粉 | 产生气泡,并有红色固体析出 | 滤液里的溶质还有_______ |
请写出产生气泡反应的化学方程式:_________。
(3)有同学提出可以直接观察滤液的颜色判断滤液中是否含有硫酸铜,同学们对硫酸铜溶液为什么呈蓝色很感兴趣,决定探究硫酸铜溶液中哪种粒子使溶液呈蓝色。设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
①取少量_______溶液,观察颜色 | 溶液呈无色 | 硫酸根离子不能使溶液呈蓝色 |
②取少量硫酸铜溶液,观察颜色 | 溶液呈蓝色 | 铜离子使溶液呈蓝色 |
(4)除了(3)中的实验方案外,你还能设计其他方案探究硫酸铜溶液中是铜离子使溶液呈蓝色吗?实验所需的药品和仪器任选,请简述实验操作和实验现象。
实验操作:___________。
实验现象:____________。
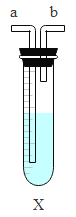
【题目】西汉东方朔所撰的《申异经》中有“西北有宫,黄铜为墙,题曰地皇之宫”的记载。黄铜是铜锌合金。为测定某黄钢样品中铜的质量分数,某同学取黄铜样品与足量稀硫酸充分反应(如图所示),测得相关数据如表。

反应前 | 反应后 | ||
装置质量 | 黄铜样品质量 | 稀硫酸质量 | 装置及装置内物质的总质量 |
260.0g | 50.0g | 100.0g | 409.5g |
计算:
(1)实验过程中,产生氢气的质量为 g。
(2)该黄铜样品中铜的质量分数(计算结果精确到0.1%)。