题目内容
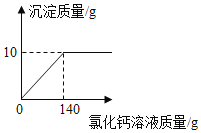
【题目】某纯碱样品中含有少量氯化钠,现取该样品12g溶解在100g水中,再向其中逐滴加入氯化钙溶液,产生的沉淀与加入氯化钙溶液的质量关系如图所示:
计算:
(1)纯碱中碳酸钠的质量分数![]() 结果精确到
结果精确到![]() ,下同
,下同![]() ______;
______;
(2)恰好完全反应时,所得溶液中溶质的质量分数_______。
【答案】88.3% 5.4%
【解析】
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钙。反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl。
解(1)设纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y,

![]() ,
,
得x=10.6g,y=11.7g,
纯碱样品中碳酸钠的质量分数:![]() ×100%
×100%![]() 88.3%,
88.3%,
(2)所得溶液中的溶质为氯化钠,来源为样品中的少量氯化钠和反应生成的氯化钠,其质量分数为![]() ×100%
×100% ![]() 5.4%。
5.4%。
答:(1)纯碱中碳酸钠的质量分数约 88.3%;(2)恰好反应时,所得溶液中溶质的质量分数约为5.4%。

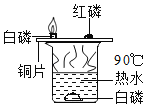
【题目】下列实验方案,不能达到相应实验目的的是
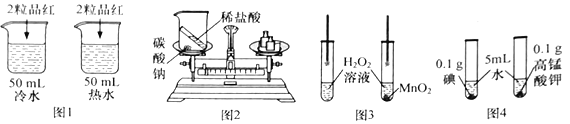
A. 图1:探究温度对分子运动快慢的影响 B. 图2:验证质量守恒定律
C. 图3:探究MnO2能否加快H2O2的分解 D. 图4:探究影响物质溶解性的因素
【题目】某兴趣小组同学利用下图所示装置探究燃烧的条件。支管1与支管2用橡胶导管相连,组装好整套装置,检查气密性良好。两个烧杯中分别注入热水和冷水;两支试管中加入少量(绿豆大小)用滤纸吸干水分的白磷,盖上胶塞。
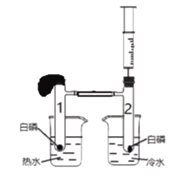
步骤 | 操作 | 现象 |
① | 把两支试管分别放入装有热水和冷水的烧杯中 | 热水烧杯中试管1内白磷燃烧,现象明显,产生大量白烟; |
② | 交换烧杯 | 试管2内白磷不燃烧 |
③ | 用注射器注入氧气 | 试管2内白磷燃烧,现象明显,产生大量白烟; |
④ | 待反应彻底结束后,用注射器注入热水 | 白烟消失 |
(1)实验开始前,检查装置气密性良好的操作与现象是_______。
(2)步骤①中试管2内白磷不燃烧的原因是_______。
(3)对比_______(填实验步骤的序号)可知燃烧需要氧气。
(4)装置中的气球所起作用是_______。