题目内容
【题目】生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 11.6g | 94.8g | 156g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)生成氢气的质量为_____ g;
(2)样品中碳的质量分数_____ (计算结果保留到0.1%);
(3)反应后得到氯化亚铁质量_____。
【答案】0.4g 3.4% 25.4g
【解析】
(1)由质量守恒定律可知烧杯质量+样品得到质量+稀盐酸的质量=烧杯+剩余物的总质量+生成的氢气质量,故生成氢气的质量为50g+11.6g+94.8g-156g =0.4g;
(2)铁与稀盐酸反应生成氯化亚铁和氢气,设样品中铁的质量为x,计算过程如下:
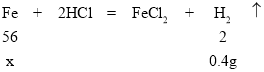
![]() ,解得x=11.2g,所以样品中铁的质量为11.2g,则样品中碳的质量为11.6-11.2=0.4g,所以碳的质量分数为
,解得x=11.2g,所以样品中铁的质量为11.2g,则样品中碳的质量为11.6-11.2=0.4g,所以碳的质量分数为![]() ≈3.4%;
≈3.4%;
(3)设氯化亚铁的质量为y,计算过程如下:
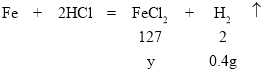
![]() ,解得y=25.4g,故反应后得到的氯化亚铁质量为25.4g。
,解得y=25.4g,故反应后得到的氯化亚铁质量为25.4g。

练习册系列答案
相关题目